
КАТЕГОРИИ:
АстрономияБиологияГеографияДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРиторикаСоциологияСпортСтроительствоТехнологияФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Билет №5
1. Конфигурация. Стереоизомерия молекул с одним центром хиральности. Проекционные формулы Фишера. D,L-система стереохимической номенклатуры. Стереоизомерия молекул с двумя и более центрами хиральности. Энантиомеры, σ- и π-диастереомеры, мезоформа, рацематы.Представление о R,S-номенклатуре.
Конфигурация молекул в стереохимии характеризует пространственное расположение атомов или групп атомов у асимметрического атома, у несимметрично замещенной двойной связи, у малого (жёсткого) цикла, у центрального атома в комплексах. Различия между конфигурациями молекул обусловливают существование двух видов устойчивых стереоизомеров — геометрических и оптических. Конфигурация молекулы не меняется при изменении её конформации, т.е. при повороте вокруг простых связей отдельных частей молекулы относительно друг друга.
Молекулы с одним центром хиральности могут существовать в виде двух энантиомеров (D- и L-формы, являющиеся зеркальным отражением друг друга). Для изображения трёхмерной проекции на плоскости применяются так называемые проекционные формулы Фишера. В проекции Фишера химические связи изображаются в виде горизонтальных и вертикальных линий, на перекрестьях которых находятся стереоцентры. Углеродный скелет изображают вертикально, при этом сверху находится атом углерода, с которого начинается нумерация скелета (например, альдегидный С-атом для альдоз). Кроме того, в проекции Фишера все горизонтальные связи направлены в сторону наблюдателя, а вертикальные — удалены от наблюдателя. Данное условие важно для правильного построения проекции Фишера, а также при восстановлении трёхмерной структуры молекулы из её проекции. По этой причине проекцию Фишера нельзя вращать на 90° или 270°, так как это приведёт к изменению конфигурации стереоцентров. Для приведения формулы молекулы к классическому виду допускается либо поворот на 180°, либо проведение чётного числа перестановок.

Для углеводов, α-гидроксикислот, α-аминокислот широко используют также D,L-систему, основанную на сравнении конфигурации рассматриваемого асимметрического центра с конфигурацией соответствующего энантиомера глицеринового альдегида. При рассмотрении проекционных формул Фишера расположение групп ОН или NH2 слева обозначается символом L (от лат. laevus – левый), справа – символом D (от лат. dexter – правый).
Молекулы с двумя и более центрами хиральности имеют число стереоизомеров, высчитываемое по формуле N=2n, где N – общее число стереоизомеров, n – количество центров хиральности в молекуле. Однако их число может уменьшаться из-за наличия мезоформ, возникающих в случае, когда из-за наличия в молекуле плоскости симметрии два энантиомера являются одним и тем же веществом (при повороте формулы Фишера такого вещества на 180° она совпадёт с предполагаемым энантиомером; принято говорить, что пара энантиомеров вырождается в одну мезоформу).
Энантиомеры – стереоизомеры, являющиеся зеркальным отражением друг друга, главным условием наличия которых является наличие как минимум одного центра хиральности в молекуле. Могут вырождаться в мезоформу (см. выше). В отличие от энантиомеров, σ-диастереомеры не являются зеркальным отражением друг друга. Рацемат — эквимолярная смесь двух энантиомеров. Рацематы не обладают оптической активностью, а также отличаются по свойствам от индивидуальных энантиомеров.

π-диастереомеры для своего существования вовсе не требуют наличия центра хиральности в молекуле. Они отличаются друг от друга пространственным расположением заместителей относительно плоскости двойной связи. Например, малеиновая и фумаровая кислоты отличаются друг от друга взаимным расположением карбоксильных групп у двойной связи.

Полное название диастереомера можно сформировать при помощи обозначений R/S, характеризующих абсолютную конфигурацию каждого стереоцентра молекулы. Таким образом, диастереомер получит исчерпывающее название, по которому впоследствии можно восстановить его структуру с точностью до всех стереоцентров.
В этой системе старшими считаются те из заместителей, у которых с рассматриваемым хиральным элементом непосредственно связан атом с большим атомным номером. Если эти атомы одинаковы по старшинству, то рассматривают «второй слой», в который входят атомы, связанные с атомами «первого слоя», и т.д., до появления первого различия; номера атомов, связанных двойной связью, при определении старшинства удваивают. Обозначение R (от лат. rectus-правый) получает тот из энантиомеров, в котором при рассмотрении модели со стороны, противоположной младшему заместителю, старшинство остальных заместителей падает по часовой стрелке. Падение старшинства против часовой стрелки соответствует S-обозначению (от лат. sinister-левый).
2. Химические свойства α-аминокислот (образование внутрикомплексных солей, реакции этерификации, ацилирования, образования иминов, гидроксилирования). Биологически важные реакции дезаминирования (неокислительного и окислительного).
Аминокислоты как амфотерные соединения образуют соли как с кислотами (по группе NH2), так и со щелочами (по группе СООН):

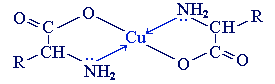
С ионами тяжелых металлов α-аминокислоты образуют внутрикомплексные соли . Комплексы меди (II), имеющие глубокую синюю окраску, используются для обнаружения α-аминокислот.
Реакция этерификации (по группе СООН):

Ацилирование (образование N-ацильных производных) происходит при взаимодействии аминокислот галогенангидридами или ангидридами. В результате получаются соединения, которые можно рассматривать либо как N-ацильные производные, либо как N-замещённые амиды.

N-ацилпроизводные гидролизуются с образованием исходной α-аминокислоты. Поэтому реакция ацилирования широко используется для защиты аминогруппы.
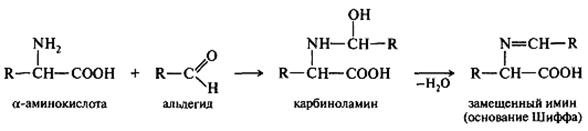
Образование иминов (оснований Шиффа):
В результате гидроксилирования в боковой радикал вводится гидроксильная группа. Это характерно, например, для лизиновых и пролиновых остатков в молекуле коллагена. Ферментативное гидроксилирование остатка пролина происходит с участием аскорбиновой кислоты (витамина С), играющей роль кофермента.

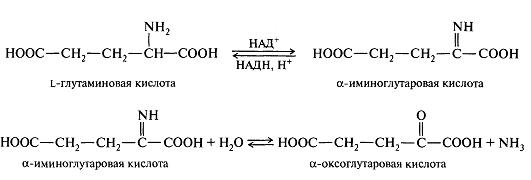
Процесс окислительного дезаминрования в организме может осуществляться с участием ферментов дегидрогеназ и кофермента НАД+ или НАДВ+. Например, при окислительном дезаминировании L-глутаминовой кислоты образуется α-оксоглутаровая кислота. На первой стадии осуществляется дегидрирование (окисление) глутаминовой кислоты до α-иминоглутаровой кислоты. На второй стадии происходит гидролиз, в результате которого получаются α-оксоглутаровая кислота и аммиак. Стадия гидролиза протекает без участия фермента. Образующийся аммиак включается в цикл мочевины.
Неокислительное дезаминирование происходит с участием ферментов в живых организмах и образуются α,β непредельные кислоты (приведённая ниже реакция идёт в присутствие фермента аспартазы):
HOOC – CH – CH2 – CH – CH3 à HOOC – CH = CH – CH2 – CH3+ NH3
| | |
NH2 CH3 CH3
3. Напишите проекционную формулу L-2-гидроксипропионата (L-лактата).
COOR
 |
 НО H
НО H
CH3
4. Объясните механизм алкилирования этилбензола трет-бутанолом.

Следует учитывать, что в этой реакции идёт одновременное образование двух изомерных соединений с пара- и орто-положениями заместителей. Однако здесь я рассмотрю только преимущественный вариант, то есть с образованием пара-изомера, так как механизм образования орто-изомера отт рассматриваемого практически не отличается.
H
|
C(CH3)3 – OH + H+ → C(CH3)3 – O+– H → C+(CH3)3 + H2O
Получившуюся в результате электрофильную частицу обозначу для удобства буквой Е+. Этильный радикал в этилбензоле для удобства опущен. Следует учитывать, что он подразумевается у атома углерода, противоположного тому, у которого происходят превращения.

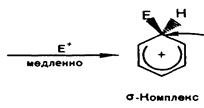
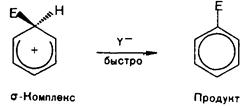
+ H+
5. Выясните возможность вступления 2-метилпропаналя и 2,2-диметилпропаналя в альдольную и кротоновую конденсацию. Приведите схему реакций, объясняющих механизм.
2,2-диметилпропаналя в реакции альдольной и кротоновой конденсации вступать не будет из-за отсутствия атома водорода у С-2, то есть невозможно провести его отщепление у С-2 с образованием аниона – промежуточного продукта реакции.
Для 2-метилпропаналя реакция альдольной конденсации будет идти следующим образом (все реакции обратимы):
CH3 CH3
| |
CH3 – CH – COH + OH- → CH3 – C- – COH + H2O
CH3 CH3 CH3 O- CH3
| | | | |
CH3 – CH – COH + C- – COH → CH3 – CH – CH – C – COH → (+H2O,-OH-)
| |
CH3 CH3
CH3 OH CH3
| | |
(+H2O,-OH-) → CH3 – CH – CH – C – COH
|
CH3
Реакция кротоновой конденсации невозможно из-за того, что необходимый атом водорода в молекуле у С-2 замещён метильным радикалом (при реакции кротоновой конденсации у конечного альдоля происходило бы отщепление гидроксогруппы у С-3 и водорода у С-2, т.е. выделялась бы молекула воды, с образованием в месте отщепления двойной связи).
Дата добавления: 2015-02-10; просмотров: 511; Мы поможем в написании вашей работы!; Нарушение авторских прав |