
КАТЕГОРИИ:
АстрономияБиологияГеографияДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРиторикаСоциологияСпортСтроительствоТехнологияФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Элементы главной подгруппы I группы
269. Растворимость в воде выше у:
A) Be(OH)2;
B) Ba(OH)2;
C) Mg(OH)2;
D) Ca(OH)2;
E) Al(OH)3.
270. Формула минерала флюорит:
A) BaCO3;
B) CaCO3*MgCO3;
C) Ca5F(PO4)3;
D) CaCO3;
E) CaF2.
271. Формула минерала кальцит:
A) BaCO3;
B) CaCO3*MgCO3;
C) Ca5F(PO4)3;
D) CaCO3;
E) CaF2.
272. Формула минерала апатит:
A) BaCO3;
B) CaCO3*MgCO3;
C) Ca5F(PO4)3;
D) CaCO3;
E) CaF2.
273. К минералам магния не относится:
А) Магнезит
В) Доломит
С) Сильвинит
Д) Шпинель
Е) Карналлит
274. Одновременно кальций и магний содержатся в минерале:
А) Магнезит
В) Доломит
С) Сильвинит
Д) Шпинель
Е) Карналлит
275. Магний и алюминий содержатся в минерале:
А) Магнезит
В) Доломит
С) Сильвинит
Д) Шпинель
Е) Карналлит
276. Калий и магний содержит минерал:
А) Магнезит
В) Доломит
С) Сильвинит
Д) Шпинель
Е) Карналлит
277. Только один металл содержится в минерале:
А) Магнезит
В) Доломит
С) Сильвинит
Д) Шпинель
Е) Карналлит
278. Наиболее важный сплав магния называется:
А) Электроном
В) Силумином
С) Магналием
Д) Мельхиором
Е) Манганином
279. Электрон – это сплав на основе:
А) Магния
В) Алюминия
С) меди
Д) Железа
Е) Никеля
280. Сплав магния, в котором содержится 3-10 % алюминия и 0,2-3 % цинка:
А) Электрон
В) Силумин
С) Магналий
Д) Мельхиор
Е) Манганин
281. Временная жесткость воды обусловлена присутствием в ней солей:
A) CaCl2; MgCl2;
B) CaSO4; MgSO4;
C) Ca(HCO3)2; Mg(HCO3)2;
D) CaCO3; MgCO3;
E) NaCl; KCl.
282. Постоянная жесткость воды обусловлена присутствием в ней солей:
A) Ca(HCO3)2; Mg(HCO3)2;
B) CaCl2; MgCl2; CaSO4; MgSO4;
C) CaCO3; MgCO3;
D) NaCl; KCl;
E) Na2SO4; K2SO4.
283. Устранению временной жесткости воды соответствует реакция:
A) CaCl2 + Na2CO3 ® CaCO3¯ + 2NaCl;
B) MgSO4 + Na2CO3 ® MgCO3¯ + Na2SO4;
C) Na2SO4 + CaCl2 ® CaSO4¯ + 2NaCl;
D) K2SO4 + MgCl2 ® MgSO4¯ + 2KCl;
E) Ca(HCO3)2 ® CaCO3¯ + CO2 + 2H2O.
284. Устранению временной жесткости воды соответствует реакция:
A) CaCl2 + Na2CO3 ® CaCO3¯ + 2NaCl;
B) MgSO4 + Na2CO3 ® MgCO3¯ + Na2SO4;
C) Na2SO4 + CaCl2 ® CaSO4¯ + 2NaCl;
D) K2SO4 + MgCl2 ® MgSO4¯ + 2KCl;
E) Ca(HCO3)2 + Ca(OH)2 ® 2CaCO3¯ + 2H2O.
285. Минерал витерит:
A) SrSO4;
B) SrCO3;
C) BaSO4;
D) BaCO3;
E) CaSO4.
286. Неверное утверждение:
A) Соли кальция окрашивают пламя в кирпично-красный цвет;
B) Соли стронция окрашивают пламя в карминово-красный цвет;
C) Соли бария окрашивают пламя в желтовато-зеленый цвет;
D) Соли калия окрашивают пламя в зеленый цвет;
E) Соли натрия окрашивают пламя в желтый цвет.
287. Осадок, который растворяется в избытке разбавленной щелочи, образуется в случае:
A) FeSO4 + NaOH ® ;
B) CuSO4 + NaOH ® ;
C) NiSO4 + NaOH ® ;
D) CoCl2 + NaOH ® ;
E) ZnSO4 + NaOH ®.
288. Соединения кальция окрашивают пламя в цвет:
A) Желтый;
B) Фиолетовый;
C) Кирпично-красный;
D) Карминово-красный;
E) Желтовато-зеленый.
289. Молекула гидрида бериллия имеет структуру:
A) Квадратную;
B) Линейную;
C) Тетраэдрическую;
D) Октаэдрическую;
E) Шарообразную.
290. Реакция пройдет до конца между ионами:
A) Na+ + SiО32- 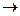
B) K+ + CO32- 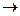
C) Ca2+ + CI- 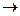

D) Ca2+ + CO32- 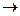
E) Na+ + HCO3- 

291. Более сильными основными свойствами обладает:
A) Be(OH)2;
B) Mg(OH)2;
C) Ca(OH)2;
D) Sr(OH)2;
E) Ba(OH)2.
292. Для получения СаСО3 к раствору Са(НСО3)2 следует прибавить:
A) Са(ОН)2;
B) HCI;
C) H2O;
D) CO2;
E) HNO3 .
293. Гидроксид магния растворяется в растворе хлорида аммония, так как:
A) Образуется растворимое комплексное соединение магния;
B) Гидроксид магния проявляет амфотерные свойства;
C) Образующийся в результате реакции Mg(OH)2 + 2NH4Cl ® гидроксид аммония является более слабым основанием, чем гидроксид магния;
D) В растворе NH4Cl имеются полярные молекулы аммиака, способствующие диссоциации Mg(OH)2;
E) Повышается температура смеси, способствующая растворению гидроксида магния.
294. Гидроксид магния Mg(OH)2 растворяется в растворе:
А) KCI
В) NaCI
С) NH4CI
Д) КNO3
Е) NaNO3
295. Плотность лития (г/см3 ):
А) 0,534
В) 2,7
С) 2,07
Д) 7,87
Е) 22,5
296. При горении на воздухе образует супероксид:
A) Литий;
B) Натрий;
C) Калий;
D) Барий;
E) Кальций.
297. Оксид натрия можно получить по реакции:
A) Na + O2 ® ;
B) Na2O2 + Na ®;
C) NaNO3  ;
;
D) Na + H2O ®;
E) Na2CO3  .
.
298. Реакция, в результате которой не получается гидроксид натрия:
A) Na + H2O ® ;
B) Na2O + H2O ® ;
C) NaCl  ;
;
D) NaCl  ;
;
E) Na2CO3 + Ca(OH)2 ® .
299. При сгорании на воздухе образует пероксид:
A) Фосфор;
B) Литий;
C) Натрий;
D) Водород;
E) Алюминий
300. При горении калия на воздухе преимущественно образуется:
A) K2O;
B) K2O2;
C) KO2;
D) KO3;
E) KOH.
301. Продуктом взаимодействия лития с воздухом является преимущественно:
A) Li2O;
B) Li2O2;
C) Li3N;
D) LiOH;
E) Li2CO3.
302. На воздухе металлический натрий покрывается белой пленкой:
A) Na2O;
B) Na2O2;
C) Na3N;
D) NaOH;
E) Na2CO3.
303. При непосредственном взаимодействии с кислородом оксид типа Э2О образует:
А) литий
В) натрий
С) калий
Д) рубидий
Е) цезий
304. При непосредственном взаимодействии с кислородом соединение типа Э2О2 образует:
А) литий
В) натрий
С) калий
Д) рубидий
Е) цезий
305. При сгорании калия, рубидия, цезия на воздухе образуется соединение типа:
А) Э2О
В) Э2О2
С) ЭО2
Д) ЭОН
Е) ЭО3
306. Калий не содержится в минерале:
А) Сильвин
В) Сильвинит
С) Карналлит
Д) Криолит
Е) Каинит
307. При взаимодействии 3,42 г щелочного металла с водой выделяется 448 см3 водорода (н.у.). Этот щелочной металл:
A) К;
B) Na;
C) Rb;
D) Li;
E) Cs.
308. Соединения калия окрашивают пламя в цвет:
A) Желтый;
B) Фиолетовый;
C) Кирпично-красный;
D) Карминово-красный;
E) Желтовато-зеленый.
309. Основные свойства гидроксидов элементов IА группы по мере увеличения порядкового номера:
A) Уменьшаются;
B) Возрастают;
C) Остаются неизменными;
D) Уменьшаются, а затем возрастают;
E) Возрастают, а затем уменьшаются.
Дата добавления: 2015-02-10; просмотров: 145; Мы поможем в написании вашей работы!; Нарушение авторских прав |