
КАТЕГОРИИ:
АстрономияБиологияГеографияДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРиторикаСоциологияСпортСтроительствоТехнологияФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Валентные возможности атомов
Для ответа по п.4 задания I части необходимо из рекомендованного вам «Опорного конспекта лекций по химии» (или из других учебников по химии для высшей школы) выучить раздел «Энергетическое состояние электрона в атоме» (стр. 48-50). Особое значение здесь будет играть схема относительного расположения орбиталей для многоэлектронных атомов (рис. 6(б), стр. 48).
Для начала необходимо:
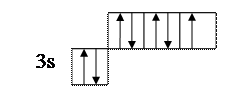
- написать электронную формулу атома хлора: 1s22s22p63s23p5;
- выделить внешние электроны: 3s23p5;
|
Для дальнейшего ответа необходимо знать основные представления по химической связи («Опорный конспект по химии», стр. 59-63), в том числе:
- основное и возбужденное состояние электронов в атоме (стр. 49);
- обменный механизм образования ковалентной химической связи (стр. 62);
- донорно-акцепторный механизм образования ковалентной химической связи (стр. 62).
Примечание. При рассмотрении валентных возможностей атомов следует учитывать указанные возможности по образованию прежде всего ковалентного типа связи (неполярной и полярной). К тому же следует понимать, что валентные возможности и конкретная валентность (ковалентность) - разные понятия. Валентные возможности – это теоретическая «максимальная» валентность, которая, как правило, всегда меньше валентности конкретных атомов элементов в реально существующих соединениях. При этом, численная величина валентных возможностей, как и численная величина валентности, знака не имеет. При определении валентных возможностей необходимо найти максимально возможные значения валентных возможностей того или иного атома, а также их количество по обменному и донорно-акцепторному механизмам образования ковалетной химической связи. Определение валентных возможностей корректно проводить для атомов неметаллов или полуметаллов, которые могут образовывать химические соединения с ковалентным типом (характером) химической связи.
Для определения валентных возможностей атома хлора в нормальном состоянии необходимо:
- сосчитать количество свободных внешних электронов и количество электронных пар или количество свободных атомных ячеек на последнем задействованном энергетическом подуровне. (Задействованным подуровнем считается такой, на котором в нормальном (невозбужденном) состоянии имеется хотя бы один электрон). В нашем случае количество неспаренных электронов у атома хлора в нормальном состоянии равно 1.
- сосчитать количество электронных пар на внешних подуровнях. В нашем случае их 3 – одна на подуровне 3s и две на подуровне 3p. Таким образом, валентные возможности (В.в.) атома хлора в нормальном состоянии равны 4: В.в. (Cl) = 1обм + 3дд.а., в том числе одна по обменному механизму (обм), три – по донорно-акцепторному (д.а.), где атом хлора выступает в качестве донора (д.), т.е. атома, предоставляющего при образовании ковалентной химической связи электронную пару. Формальная схема реализации таких возможностей представлена ниже:
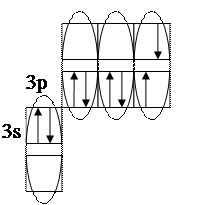

Для определения валентных возможностей атома хлора в возбужденном состоянии необходимо:
- построить для атома хлора графическую электронную формулу (2-й вариант) с учетом ближайшего незаполненного энергетического подуровня. В нашем случае – это 3d-подуровень (рис. 6, стр. 48. «Опорный конспект лекций по химии»).
 Графическая электронная формула будет выглядеть следующим образом:
Графическая электронная формула будет выглядеть следующим образом:
Отметим, что при возбуждении электронов, т.е. переводе их на более высокий энергетический подуровень того же энергетического уровня, определяемого значением главного квантового числа n (в нашем случае n=3), энергетические затраты (Ев) не столь значительные и могут быть скомпенсированы при образовании химической связи (Ехс). При переходе электрона с энергетического подуровня одного электронного слоя на энергетический подуровень другого электронного слоя, энергетические затраты (Е1в) оказываются больше, чем выигрыш энергии при образовании химической связи, т.е. такая валентная возможность не может быть даже формально реализована ни в каких химических соединениях. Поэтому такие валентные возможности не учитываются. Вышесказанное поясняют схемы, приведенные ниже.

 Образование химической связи энергетически невыгодно.
Образование химической связи энергетически невыгодно.
Образование химической связи энергетически возможно.
Таким образом, в нашем случае распределение электронов для атома хлора в возбужденном состоянии будет выглядеть следующим образом:

Исходя из данной графической формулы, валентные возможности атома хлора в возбужденном состоянии (Cl*) равны 9: В.в. (Cl*) = 7обм + 2ад.а., в том числе семь по обменному механизму (обм), две – по донорно-акцепторному в качестве акцептора (а), т.е. атома предоставляющего свободные атомные ячейки на задействованном энергетическом уровне. Формальная схема гипотетической реализации таких возможностей представлена ниже:


Еще раз подчеркнем, что такие максимальные валентные возможности, как правило, не могут быть реализованы в реальных химических соединениях, в частности из-за геометрических размеров атомов.
Дата добавления: 2015-02-10; просмотров: 126; Мы поможем в написании вашей работы!; Нарушение авторских прав |