
КАТЕГОРИИ:
АстрономияБиологияГеографияДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРиторикаСоциологияСпортСтроительствоТехнологияФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Билет № 23. 1. Температура. Температурные шкалы.
1. Температура. Температурные шкалы.
Температура — скалярная физическая величина, описывающая состояние термодинамического равновесия (состояния, при котором не происходит изменения микроскопических параметров).
Температура как термодинамическая величина характеризует тепловое состояние системы и измеряется степенью его отклонения от принятого за нулевое.
Температура как молекулярно-кинетическая величина — физическая величина, характеризующая интенсивность хаотического, теплового движения всей совокупности частиц системы и пропорциональная средней кинетической энергии поступательного движения одной частицы.
Ек = 3/2 kT (1), где k = 1,38 • 10-23 Дж/К и называется постоянной Больцмана.
Постоянная Больцмана связывает температуру в энергетических единицах (Дж) с температурой в градусах.
Из (1) следует, что при Ек = 0 и Т = 0;
Температура, при которой прекращается хаотическое движение частиц тела,
называется абсолютным нулем.
При Т = 0 скорость поступательного движения молекул равна нулю, т. е прекращается только тепловое движение. Другие (нетепловые) формы движения будут наблюдаться и при абсолютном нуле.
Абсолютный нуль температур недостижим, так как любое охлаждение основано на испарении молекул с поверхности, а при приближении к абсолютному нулю скорость поступательного движения молекул настолько замедляется, что испарение практически прекращается.
Измеряется температура термометрами в градусах различных температурных шкал.
Существует 5 наиболее известных температурных шкал: стоградусная, или шкала Цельсия (ºC), Фаренгейта (ºF), абсолютная, или шкала Кельвина (K), шкала Реомюра (ºR) и шкала Ранкина (ºRa).
Абсолютная термодинамическая шкала (шкала Кельвина) названная в честь знаменитого английского физика, лорда Кельвина, в которой за ноль принят абсолютный ноль температур. Вычисления дают результат, что абсолютный нуль температуры равен -273 °С. Таким образом, между абсолютной шкалой температур и шкалой Цельсия существует связь Т = t °C + 273.
Шкала Фаренгейта
Была предложена зимой 1709 года немецким учёным Габриэлем Фаренгейтом. По этой шкале за нуль принималась точка, до которой в один очень холодный зимний день (дело было в Данциге) опустилась ртуть в термометре учёного. В качестве другой отправной точки он выбрал температуру человеческого тела. По этой не слишком логичной системе точка замерзания воды на уровне моря оказалась равной +32º, а точка кипения воды +212º. Шкала популярна в США и Великобритании.
Шкала Реомюра
В 1731 году французский учёный Рене де Реомюр предложил температурную шкалу, основанную на использовании спирта, обладающего свойством расширяться. За нижнюю реперную точку была принята точка замерзания воды. Градус Реомюр произвольно определил как одну тысячную от объёма, который занимает спирт в резервуаре и трубке термометра при нулевой точке. При нормальных условиях точка кипения воды по этой шкале составляет 80º. Шкала Реомюра ныне повсеместно вышла из употребления.
Шкала Цельсия
В 1742 году шведский астроном Андерс Цельсий предложил шкалу, в которой за нуль принималась температура смеси воды и льда, а температура кипения воды приравнивалась к 100º. За градус принимается сотая часть интервала между этими реперными точками. Единица температуры по абсолютной шкале называется Кельвином и выбрана равной одному градусу по шкале Цельсия 1 К = 1 °С. Эта шкала более рациональна, чем шкалы Фаренгейта и Реомюра, и широко используется в науке.
Шкала Ранкина
Была предложена шотландским инженером и физиком Уильямом Ранкином. Нуль её совпадает с нулём термодинамической температуры, а по размеру 1ºRa равен 5/9 К. Т. е. принцип тот же, что и в шкале Кельвина, только по размерности шкала Ранкина совпадает не со шкалой Цельсия, а со шкалой Фаренгейта. Данная система измерения температуры распространения не получила.

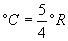 Формулы перевода шкал Фаренгейта, Кельвина, Реомюра и Ранкина в шкалу Цельсия
Формулы перевода шкал Фаренгейта, Кельвина, Реомюра и Ранкина в шкалу Цельсия





Любое макроскопическое тело или группа макроскопических тел называется термодинамической системой.
Тепловое или термодинамическое равновесие - такое состояние термодинамической системы, при котором все ее макроскопические параметры остаются неизменными: не меняются объем, давление, не происходит теплообмен, отсутствуют переходы из одного агрегатного состояния в другое и т.д. При неизменных внешних условиях любая термодинамическая система самопроизвольно переходит в состояние теплового равновесия.
2. Ядерные реакции. Деление ядер урана. Цепные ядерные реакции.
Деление ядер урана

Делиться могут только ядра некоторых тяжелых элементов, например, урана.

Ядро урана - 235 имеет форму шара. Поглотив нейтрон, ядро возбуждается и начинает деформироваться.
Оно растягивается из стороны в сторону до тех пор, пока кулоновские силы отталкивания между протонами не начнут преобладать над ядерными силами притяжения. После этого ядро разрывается на две части и осколки разлетаются со скоростью 1/30 скорости света. При делении ядра образуются еще 2 или 3 нейтрона.
Цепная ядерная реакция - это процесс, в котором одна проведенная реакция вызывает последующие реакции такого же типа.
 При делении одного ядра урана образовавшиеся нейтроны могут вызвать деления других ядер урана, при этом число нейтронов нарастает лавинообразно.
При делении одного ядра урана образовавшиеся нейтроны могут вызвать деления других ядер урана, при этом число нейтронов нарастает лавинообразно.
Коэффициентом размножения нейтронов k называется отношение числа образовавшихся нейтронов в одном акте деления к числу таких нейтронов в предыдущем акте деления
При k меньше 1 реакция затухает, т.к. число поглощенных нейтронов больше числа вновь образовавшихся.
При k больше 1 почти мгновенно происходит взрыв.
При k равном 1 идет управляемая стационарная цепная реакция.
Цепная реакция сопровождается выделением большого количества энергии.

Для осуществлении цепной реакции не получается использовать любые ядра, делящиеся под влиянием нейтронов.
Используемый в качестве топлива для атомных реакторов химический элемент уран состоит в природе из двух изотопов: урана-235 и урана - 238.
В природе изотопы урана-235 составляют всего лишь 0,7% от всего запаса урана, однако именно они пригодны для проведения цепной реакции, т.к. делятся под влиянием медленных нейтронов.
Ядра урана-238 могут делиться лишь под влиянием нейтронов большой энергии (быстрых нейтронов). Такую энергию имеют только 60% нейтронов, появляющихся при делении ядра урана-238. Примерно только 1 из 5 образовавшихся нейтронов вызывает деление ядра.
Условия протекания цепной реакции в уране-235:
- минимальное количество топлива (критическая масса), необходимое для проведения управляемой цепной реакции в атомном реакторе
- скорость нейтронов должна вызывать деление ядер урана
- отсутствие примесей, поглощающих нейтроны
Критическая масса:
- если масса урана мала, нейтроны будут вылетать за его пределы, не вступая в реакцию
- если масса урана велика, возможен взрыв за счет сильного увеличения числа нейтронов
- если масса соответствует критической, протекает управляемая цепная реакция
 Для урана-235 критическая масса составляет 50 кг (это, например, шар из урана диаметром 9 см).
Для урана-235 критическая масса составляет 50 кг (это, например, шар из урана диаметром 9 см).
Первая управляемая цепная реакция - США в 1942 г. (Э.Ферми)
В СССР - 1946 г. (И.В.Курчатов).
Дата добавления: 2014-10-31; просмотров: 1675; Мы поможем в написании вашей работы!; Нарушение авторских прав |