
КАТЕГОРИИ:
АстрономияБиологияГеографияДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРиторикаСоциологияСпортСтроительствоТехнологияФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Ысқаша теориялық мәлiметтер
3.3.1.Атомдық спектрлер. Сериялық заңдылықтар.
19-ғ. екiншi жартысында жүргізiлген зерттеулер нәтижесiнде әрбiр химиялық элементтiң атомдарының буы белгiлi бiр қолайлы жағдай жасалып қоздырылғанда сызықтық спектр деп аталатын жеке сызықтар жиынтығынан тұратын сызықтық спектр шығаратындығы; және де әрбiр химиялық элемент атомдарына тек осы элементке тән нақты сызықтық спектр сәйкес келетiндiгi тағайындалды. Сонымен, заттың сапалық және сандық құрамын оның сызықтық спектрiн зерттеу арқылы анықтаудың физикалық тәсiлi-спектрлiк талдау негiздерi қаланды (Киргхоф, Бунзен, 1859). Химиялық элементтердiң сызықтық спектрлерiн зерттеу нәтижелерiн талдаудан спектрлерде сызықтар ретсiз, қалай болса солай емес, заңдылықпен орналасады деген қорытынды жасалды. Ендi осы заңдылықтарды тағайындау және бұларды түсіндiру мiндетi алға қойылды.
Сутегiнiң сызықтық спектрiн егжей-тегжейлi зерттеп, швейцариялық мектеп мұғалiмi И.Бальмер (1885) спектрде сол кезде белгiлi тоғыз сызықтың толқын ұзындықтарын мына формула бойынша
 (3.1)
(3.1)
табуға болатындығын тапты; мұндағы В=364,6 нм, ал n=3,4,5,... бүтін мәндерiн қабылдайды. (3.1) формуланы Швед ғалымы И.Ридберг (1890) басқа түрде жазуды ұсынды:
 , (3.2)
, (3.2)
| |
 -спектрлiк сызықтың толқындық саны, см-1, l-толқын ұзындығы, R-тұрақты шама, Ридберг тұрақтысы деп аталады; n=3,4,5,... (3.2) формула өте жоғары дәлдiкпен тәжiрибеге сәйкес келетiн нәтижелер бередi.
-спектрлiк сызықтың толқындық саны, см-1, l-толқын ұзындығы, R-тұрақты шама, Ридберг тұрақтысы деп аталады; n=3,4,5,... (3.2) формула өте жоғары дәлдiкпен тәжiрибеге сәйкес келетiн нәтижелер бередi.
(3.2) формула қамтитын сутегi атомының спектрлiк сызықтар тобы Бальмер сериясы деп аталады. Осы формулаға қарағанда n-нiң мәнi ұлғайған сайын көршiлес сызықтардың толқын ұзындық айырмасы кеми бередi, спектрлiк сызықтар арасы жақындай түседi. Ең соңында, n=¥ болғанда Бальмер сериясының шекарасы  немесе
немесе  пайда болады.
пайда болады.
Сутегi атомы спектрiнде Бальмер сериясына жататын сызықтардан басқа сызықтар да бар. Олар бiрнеше серия құрайды.
Спектрдiң ультракүлгін бөлiгiндегi бiр топ сызықтар Лайман (1906) сериясы деп аталады:
 n=2,3,4,...
n=2,3,4,...
Сутегi спектрiнiң жақын инфрақызыл бөлiгiнде Пашен (1908) сериясы деп аталатын бiр топ сызық бар. Бұлар мына формуламен өрнектеледi:
 n=4,5,6,...
n=4,5,6,...
Бұдан басқа спектрдiң алыс инфрақызыл бөлiгiнде үш серия бар.
Олар: Брэкет сериясы (1922):  n=5,6,7,...
n=5,6,7,...
Пфунд сериясы (1924):  n=6,7,8,...
n=6,7,8,...
Хэмфри сериясы (1953):  n=7,8,9,...
n=7,8,9,...
Осы сериялардың толқындық сандары (3.2) Бальмер формуласына ұқсас, 22 орнына 12, 32, 42, 52, 62 қойылған формулалармен өрнектеледi. Сонымен, сутегi атомының барлық спектрлiк сызықтарын мынадай жалпы формуламен өрнектеуге болады:
 (3.3)
(3.3)
мұндағы m және n-бүтін сандар, және m<n; берiлген серия үшін n= m+1, m+2,...болады. Лайман сериясы үшін m=1, Бальмер сериясы үшін m=2 және т.т.
| |
3.3.2. Спектрлiк терм. Комбинациялық принцип.Атомдардың сызықтық спектрлерiн зерттеу нәтижелерiне сүйенiп, Ридберг (1889) берiлген серияның барлық сызықтарының толқындық сандары (жиiлiктерi) мына қатынасты
 (3.4)
(3.4)
қанағаттандырады деген қорытынды жасады; мұндағы m-тұрақты, серияны анықтайтын тұрақты мәнге ие сан, ал n cанының өзгерiсi (n=m+1, m 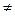 2,...) берiлген серияның барлық сызықтарын бередi; Т(m), Т(n)-спектрлiк термдер. Сутегi атомының (3.3) сериялық формуласымен салыстырудан спектрлiк термдердiң тиiсiнше мына қатынастарға
2,...) берiлген серияның барлық сызықтарын бередi; Т(m), Т(n)-спектрлiк термдер. Сутегi атомының (3.3) сериялық формуласымен салыстырудан спектрлiк термдердiң тиiсiнше мына қатынастарға
Т(m)=R/m2 және Т(n)=R/n2 (3.5)
тең болатындығы келiп шығады.
1908 ж. Ритц тәжiрибелiк деректердi қорыту нәтижесiнде комбинациялық принцип деп аталатын ереже ұсынды. Осы ережеге сәйкес, кез-келген атомның шығару спектрiндегi барлық сызықтарды спектрлiк термдердiң (3.4) комбинациясы түрінде өрнектеуге болады.
3.3.3. Атомның планетарлық моделi. 1911 ж. Резерфорд атомның ядролық (планетарлық) моделiн (үлгiсiн) ұсынды; бұл атом құрылысы жөнiндегi қазiргi көрiнiстерге келудегi маңызды қадам болды. Осы модельге сәйкес Ze оң заряды бар ядроны дөңгелек (немесе эллипстiк) орбита бойынша электрондар электростатикалық тартылыс күшi әсерiнен айналып жүредi (гравитациялық тартылыс күштерi әсерiнен планеталардың Күндi айналатындығына ұқсас). Ядро заряды электрондардың қосынды зарядына тең, өйткенi атомдар электрлiк бейтарап жүйе.
| |
3.3.4. Бор постулаттары. Атомның энергия деңгейлерiнiң диаграммасы. Аталған қарама-қайшылықтарды шешу үшін жаңа түсінiктер қажет болды. Н.Бор (1913) алғаш болып атомның планетарлық моделiн ендi ғана жаңадан пайда бола бастаған кванттық теориямен (Планк гипотезасы) байланыстыру керектiгiн алғашқы болып түсіндi. Сонымен Бор атомның кванттық теориясын жасауға бiрiншi болып ұмтылыс жасады. Бұл теория ескiргенiне қарамастан, жеткiлiктi қарапайым, бiрталай құбылыстарды көрнекi түсіндiруге мүмкіндiк бередi. Сондықтан да қазiргi уақытта да мәселен, стационарлық күйлер ұғымын енгiзгенде, қолданылады.
Бор теориясының негiзiне екi постулат алынған.
1-постулат(стационарлық күйлер постулаты): атомды нақты дискреттiк энергия мәндерiмен сипатталатын стационарлық уақытқа байланысты өзгермейтiн күйлер болады, бұл күйлерде ол энергия шығармайды. Атомның стационарлық күйлерiне стационарлық орбиталар сәйкес келедi; осы орбиталар бойынша электрондар қозғалады. Электрондар стационарлық орбиталар бойымен қозғалғанда электромагниттiк толқындар шығармайды.
Атомның стационарлық күйiндегi дөңгелек орбита бойынша қозғалатын электронның импульс моментi
 (3.6)
(3.6)
шартын қанағаттандыратын дискреттi квантталған мәндер қабылдауы тиiс; мұндағы me-электрон массасы, un-радиусы rn n-i орбитадағы оның жылдамдығы; h=h/2p.
2-постулат(жиiлiктер ережесi): атом бiр стационарлық күйден басқасына ауысқан жағдайда энергиясы тиiстi стационарлық күйлер энергияларының айырымына тең
 (3.7)
(3.7)
фотон шығарылады (жұтылады).
Em<En болған жағдайда фотон шығарылады, Em>En болғанда фотон жұтылады. Мүмкін болатын кванттық ауысуларға сәйкес келетiн дискреттiк v= (En-Em)/h жиiлiктер жиыны атомның сызықтық спектрiн анықтайды.
Бор постулаттары классикалық физика түсінiктерiмен қарама-қайшы келедi. Бiрақ атом дүниесiн бейнелеуде дәл түсінiктерден бас тарту және Планк тұрақтысының енгiзiлуi революциялық физикалық идеялардың ұсынылуына және қазiргi кванттық теорияның жасалуына алып келдi.
| |
 (3.8)
(3.8)
Осыдан n-күйдегi атом энергиясы T(n) терммен мына қатынаспен байланысқандығы көрiнедi
En=-hcTn (3.9)
Бор постулаттарына сүйенiп комбинациялық принциптi көрнекi түрде көрсететiн диаграммасын тұрғызуға болады (3.1-сурет). Әдетте энергия деңгейлерiн сызықтық масштабта салады. Атом үшін деңгейлердiң араларына тән қашықтық 1эВ шамасында болады.

3.1-сурет. Суретте бiрнеше ауысулардың жиiлiктерi келтiрiлген.
Ең аз энергия Е1 сәйкес келетiн негiзгi күйде атом мейлiнше ұзақ тұрады. Ал қалған барлық күйлер қоздырылған болады. Атомды осындай күйге ауыстыру процесi қоздыру деп аталады. Қозған күйде атом салыстырмалы қысқа уақытқа, әдетте t~10-8 с кiдiредi. Бiрақ бұл уақыт атомдық масштабта ұзақ уақытқа саналады. өйткенi жарық сәулесiнiң жиiлiгi ~1014 с-1, ал осы жарық t=10-8 с уақыт iшiнде 106 тербелiс жасайды.
| |
Атом энергиясының санақ басы әдетте оның байланысқан күйлерiне сәйкес келетiн барлық Е1, Е2, Е3,... дискреттiк мәндерi терiс таңбалы (Е<0) болатындай таңдалып алынады. Оң мәндер (Е>0) жағдайында атом күйлерi байланыспаған-атом оң ионға және электронға ыдырайды. Электронды атомнан бөлiп алу процесi иондау деп аталады. Иондалған күйлерде ион және электронның қозғалыстары бiр-бiрiнен тәуелсiз болатындықтан бұлардың қосынды Е энергиясы кез-келген мән қабылдай алады, яғни квантталмайды. Еi иондану энергиясы деп негiзгi күйде тұрған атомға оны иондау үшін берiлуге тиiс ең аз энергияны айтады. Диаграммадан иондану энергиясы атомның негiзгi күйi энергиясының абсолюттiк шамасына тең болатындығы көрiнедi: 
Иондану энергиясын әдетте эВ-пен өрнектейдi. Бұған осы жағдайда иондану потенциалы терминi қолданылады.
Әр түрлi стационарлық күйлердегi атомның құрылымы да әр тұрлi болады. Сонымен, атом бiр стационарлық күйден екiншiсiне ауысқанда оның құрылымы да өзгерiске ұшырайды. Ең елеулi өзгерiс иондану кезiнде, атом электроннан айырылғанда, болады.
Атом, hv энергиясы Ei иондалу энергиясынан басым келетiн, яғни  , фотонды жұту нәтижесiнде атомның иондануы мүмкін. Бұл процесс фотоиондану деп аталады. Атомнан жұлынып шығарылған электронның кинетикалық энергиясы
, фотонды жұту нәтижесiнде атомның иондануы мүмкін. Бұл процесс фотоиондану деп аталады. Атомнан жұлынып шығарылған электронның кинетикалық энергиясы  болады. Фотоиондануға керi процесс радиациялық рекомбинация деп аталады. Осы процесс нәтижесiнде ион мен электрон байланысып стационарлық күйлердiң бiрiндегi атом пайда болады, ал босатылған энергия бiр немесе бiрнеше фотон түрінде шығарылады.
болады. Фотоиондануға керi процесс радиациялық рекомбинация деп аталады. Осы процесс нәтижесiнде ион мен электрон байланысып стационарлық күйлердiң бiрiндегi атом пайда болады, ал босатылған энергия бiр немесе бiрнеше фотон түрінде шығарылады.
Атомды қоздыру немесе иондауға қажеттi энергия, оны белгiлi жиiлiктегi жарықпен жарықтандырғанда ғана емес, кинетикалық энергиясы қайсыбiр табалдырық шамадан артық басқа бөлшектермен серпiмсiз соқтығысқанда да атомға берiлуi мүмкін.
Мәселен газды қыздырғанда әрқашан атомдардың басқа жеткiлiктi дәрежедегi жылдам атомдармен (және де иондану нәтижесiнде газда пайда болатын электрондармен) серпiмсiз соқтығысқан жағдайда қоздырылуы (иондануы) қабат жүредi. Мұны температуралық қоздыру (иондау) дейдi. Т температураны өсiргенде қоздырылған күйлердiң әрқайсысындағы атом саны тез артады. Энергиясы Еn қоздырылған күйдiң қоныстануы Больцман үлестiрiлуiмен анықталады:
| |
 ,
,
мұндағы Nn -қоздырылған күйдегi атом саны; N1 негiзгi күйдегi атом саны; k-Больцман тұрақтысы. Бөлмелiк температура жағдайында  эВ, ал
эВ, ал  қатынасы елеусiз аз болады.
қатынасы елеусiз аз болады.
Сондықтан суық газ, егер оның атомдары басқаша жолмен қоздырылмаған болса, онда жарық шығармайды. Суық газдың жұтылу спектрiнде негiзгi күйден ауысуларға сәйкес келетiн жиiлiктерi v21, v31, v41 және т.б. сызықтардың ғана болатындығы  қатынасының аздығымен түсіндiрiледi.
қатынасының аздығымен түсіндiрiледi.
3.3.5. Сутегi атомының энергия деңгейлерi және спектрi. Еn энергия деңгейлерiнiң орналасу заңдылығы сутегi атомында ең қарапайым.
Сутегi атомының термi (3.5) формуласымен өрнектеледi. Демек, энергия мәндерiнiң дискреттi жиыны, яғни сутегi атомының энергетикалық спектрi мына формуламен анықталады:
 (3.10)
(3.10)
мұндағы A=hcR энергетикалық тұрақты; 1, 2, 3,...¥ мәндерiн қабылдайтын n саны бас кванттық сан деп аталады. Ол сутегi атомының энергия деңгейлерiн анықтайды. Энергияның терiс таңбалы болуы атомдағы электронның байланысқан күйде тұрғандығын көрсететiндiгi жайында айтылған болатын.
Сутегi атомындағы электрон энергиясының ең аз мәнiне (байланыс энергиясының ең үлкен шамасына) n=1 саны сәйкес келедi. n®¥ болғанда энергия Еn®0 болады. Бұл электронның шексiздiктегi тыныштық күйiне сәйкес келедi. n саны өскенде көршi энергия деңгейлерiнiң ара қашықтығы кемидi және нөлге асимптотикалық ұмтылатын болады. Бұл n кванттық санының мәндерi үлкен болған жағдайда энергияның үздіксiз дерлiк өзгеретiндiгiн, ал n кiшi болған жағдайда энергия мәндерi секiрмелi түрде өзгеретiндiгiн көрсетедi.

| |
(3.10) формула сутегi атомының энергия деңгейлерiн анықтайды. Осы формула бойынша 3.2-суретте сутегi атомының энергия деңгейлерiнiң диаграммасы тұрғызылған. n=1 болатын күй негiзгi, немесе қалыпты күй. Қалған күйлер (  болатын жағдайлар) атомның қозған күйлерi.
болатын жағдайлар) атомның қозған күйлерi.  шамасы атомға оның электронын E¥=0 күйге ауыстыру үшін, яғни электронның атомнан жұлынып шығарылуы үшін қажеттi ең аз энергия. Бұл атомның ионданғандығын көрсетедi. Демек физикалық мағынасы бойынша R Ридберг тұрақтысы (Дж, эВ) сутегi атомының иондану энергиясын сипаттайды. I1 шамасы иондану потенциалы (В), немесе энергиясы (эВ) деп аталады. Қайсыбiр n-iншi қоздырылған күйде тұрған атомды да иондауға болады. Сонда оның иондану потенциалы
шамасы атомға оның электронын E¥=0 күйге ауыстыру үшін, яғни электронның атомнан жұлынып шығарылуы үшін қажеттi ең аз энергия. Бұл атомның ионданғандығын көрсетедi. Демек физикалық мағынасы бойынша R Ридберг тұрақтысы (Дж, эВ) сутегi атомының иондану энергиясын сипаттайды. I1 шамасы иондану потенциалы (В), немесе энергиясы (эВ) деп аталады. Қайсыбiр n-iншi қоздырылған күйде тұрған атомды да иондауға болады. Сонда оның иондану потенциалы  .
.
Сутегi атомы спектрлiк серияларының қалай пайда болатындығын 3.2-сурет көмегiмен оңай түсінуге болады. Егер атом қозған E2 күйде тұрған болса, онда ол негiзгi күйге энергиясы hv=E2-E1 фотон шығарып барып ауысады. Осы сәуленiң толқындық саны 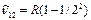 Лайман сериясының бас сызығына сәйкес келедi. Басқа қозған энергия деңгейлерiнен негiзгi деңгейге ауысқанда Лайман сериясының барлық сызықтары пайда болады. Сутегi атомы энергиялары Е3, Е4, Е5,... қоздырылған күйлерден E2 қоздырылған деңгейге ауысулар жасағанда Бальмер сериясы пайда болады. Сутегi атомының басқа сериялары да осыған ұқсас пайда болады. Сутегi атомы шығаратын ең ұзын толқынды (l»15,7м) сәулесi галактика аралық газ тұмандықтарды зерттеулер кезiнде тiркелген, ол n=701®m=700 кванттық ауысуына сәйкес келедi. Сутегi атомдарының жұтылу спектрiнде тек бiр серия-Лайман сериясы болады. Сонымен Бор постулаттарын пайдаланғанда сутегi атомы спектрiнiң қалай пайда болатындығын түсіндiру мүмкін болды. Бор және Ридберг тұрақтысын тiкелей есептеп шығарды, бұл оның теориясының үлкен жеңiсi болды.
Лайман сериясының бас сызығына сәйкес келедi. Басқа қозған энергия деңгейлерiнен негiзгi деңгейге ауысқанда Лайман сериясының барлық сызықтары пайда болады. Сутегi атомы энергиялары Е3, Е4, Е5,... қоздырылған күйлерден E2 қоздырылған деңгейге ауысулар жасағанда Бальмер сериясы пайда болады. Сутегi атомының басқа сериялары да осыған ұқсас пайда болады. Сутегi атомы шығаратын ең ұзын толқынды (l»15,7м) сәулесi галактика аралық газ тұмандықтарды зерттеулер кезiнде тiркелген, ол n=701®m=700 кванттық ауысуына сәйкес келедi. Сутегi атомдарының жұтылу спектрiнде тек бiр серия-Лайман сериясы болады. Сонымен Бор постулаттарын пайдаланғанда сутегi атомы спектрiнiң қалай пайда болатындығын түсіндiру мүмкін болды. Бор және Ридберг тұрақтысын тiкелей есептеп шығарды, бұл оның теориясының үлкен жеңiсi болды.
3.3.6.Сутегi атомын модельдiк (Бор моделi тұрғысынан) қарастыру. Сутегi атомы үшін (және сутегi тәрiздi ион) (3.10) энергияның квантталу ережесiн қарапайым модельдiк көрiнiстердi пайдаланып табуға болады.
Сутегi атомындағы электронның қозғалысын қарастырайық; оңайлық үшін дөңгелек стационарлық орбиталармен шектелейiк. Кулондық күш әсерiнен шеңбер бойымен қозғалатын электрон үшін Ньютонның 2-заңы негiзiнде мына теңдiктi жазамыз
| |
 (3.11)
(3.11)
мұндағы me және un-радиусы rn орбитадағы электронның массасы мен жылдамдығы, e0 -электрлiк тұрақты. Осы теңдiкке (3.6) квантталу шартынан un жылдамдықты қойып, теңдiктi rn-ге қатысты шешемiз; сонда n-i стационарлық орбита радиусы үшін өрнек алынады:
 (n=1, 2, 3,...) (3.12)
(n=1, 2, 3,...) (3.12)
(3.12) өрнегi сутегi атомының Бор ұсынған моделiндегi рұқсат етiлген орбиталар радиустарын анықтайды. Ядроға ең жақын орбитаға n=1 сәйкес келедi;
 (3.13)
(3.13)
Бұл тұрақты шама Бор радиусы деп аталады және ол сутегi атомының ең кiшi орбитасының мөлшерiн анықтайды. (3.12) өрнегiнен rn=n2r1 , болатындығы келiп шығады, яғни стационарлық күйлер үшін орбиталар радиустары квантталған r1, 4r1, 9r1,...мәндерге тең болады. Осы радиустардың әрқайсысы кванттық сан деп аталатын n бүтін санның квадратына пропорционал.
Сутегi атомындағы электронның толық энергиясы оның кинетикалық энергиясы  мен ядроның электростатикалық өрiсiндегi потенциалдық энергиясының
мен ядроның электростатикалық өрiсiндегi потенциалдық энергиясының  қосындысына тең:
қосындысына тең:

Стационарлық орбиталар радиустары үшін (3.12) квантталған мәндерiн ескергенде
 (n=1, 2, 3,...) (3.14)
(n=1, 2, 3,...) (3.14)
| |
 (3.15)
(3.15)
А¥ және R¥ теориялық мәндерiнің А және R тәжiрибелiк мәндерiнен аздаған айырмашылықтары бар. Айырмашылықтың болу себебi (3.15) формуланы қорытқан кезде атом ядросы қозғалмайды, яғни электрон массасына салыстырғанда шексiз ауыр деп саналды. Бұл «¥» белгiсiмен белгiленген. Шындығында ядро массасы шектеулi, осыдан электрон да, ядро да атомның ауырлық центрiн айнала қозғалады. Сондықтан ядро қозғалысын ескеру үшін me электрон массасын m=me/(1+me/M) келтiрiлген массаға ауыстыру керек, мұндағы М-ядро массасы. Демек, Ридберг тұрақтысы және энергетикалық тұрақты ядро массасына тәуелдi болуға тиiс. Сонымен, ядро массасының шектеулiлiгiн есепке алғанда, Ридберг тұрақтысы және энергетикалық тұрақты мәнi мына формулалармен анықталулары тиiс
 (3.16)
(3.16)
Дата добавления: 2014-10-31; просмотров: 566; Мы поможем в написании вашей работы!; Нарушение авторских прав |