
КАТЕГОРИИ:
АстрономияБиологияГеографияДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРиторикаСоциологияСпортСтроительствоТехнологияФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Жұмыс орындалатын тәжiрибелiк қондырғы
Жұмыс үш линзалы жарықтандырғыш жүйесi бар ИСП-28 (ИСП-30) кварц спектрографында орындалады. Li, Na, K атомдар спектрлерiн алу үшін жарық көзi ретiнде ИВС-28 генераторынан жандырылатын доғалық разряд қолданылады. Спектрлердi талдау, спектрлiк сызықтардың толқын ұзындықтарын анықтау және бұларды теңдестiру ДСП-1 немесе ПС-18 спектропроекторында спектрлiк сызықтар атласы көмегiмен жүргiзiледi.
4.3. Теориялық кiрiспе
4.3.1. Сiлтiлiк элемент атомының құрылымы. Барлық Күрделi атомдар iшiнен сiлтiлiк элементтер (Li, Na, K, Rb, Cs) атомдарының сыртқы электрондық қабықшасы ең қарапайым-ол тек жалғыз электроннан тұрады. Атомның қалған (z-1) электроны ядромен бiрiгiп жеткiлiктi орнықты атомдық қалдық құрайды (4.1-сурет). Осы атомдық қалдық құрылымы элементтердiң периодтық жүйесiндегi бұлардың (Li, Na, K ...) әрқайсысының алдында тұрған инерттi газ (He, Ne, Ar,...) атомынiкi қандай болса, дәл сондай болады. Осы жағдай сiлтiлiк металл атомын сутегi атомына ұқсас етедi және атомдық қалдық зарядының шамасы +1e-ге жуық (zТ»1) болатын тиiмдi ядро ролiн атқарады. Ал сiлтiлiк элемент атомының сутегi атомынан айырмашылығы-сыртқы (валенттiк) электронның атомдық қалдық iшiне бiраз ене алатындығымен байланысты. Жалпы кванттық заңдарға сәйкес атомдағы электрон қатаң бiр орынға шоғырланған емес, оның орнын дәл көрсетуге болмайды, негiзiнде оның координатын дәл көрсетуге болмайды, атом iшiндегi кеңiстiктiң белгiлi бiр бөлiгiнде болу ықтималдығын есептеуге немесе басқаша айтқанда, электрондық ықтималдық бұлт тығыздығын есептеуге болады. Кейбiр күйлерде сыртқы электронның ықтималдық бұлты атом қалдығы iшiне енiп кетедi, бұл жағдайда электронның әсерлесетiн zT тиiмдi ядро заряды өсетiн болады.
| |
Z-(z-1)e=+e. Осының салдарынан тиiмдi өрiс +1е нүктелiк зарядтың кулондық өрiсiмен дәл келедi, ал U(r) потенциалы сутегi атомынiкi сияқты болады:

r®0 болатын ядроға жақын маңайда экрандау болмайды да электрон ядромен тiкелей әсерлеседi.
Осы жағдайдағы электронның атомдық қалдықпен әсерлесуiнiң потенциалдық энергиясы былай анықталады:

Ал r-дiң бүкiл өзгеру аймағы үшін
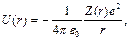
мұндағы z(r)- r өскенде шамасы z -тен 1-ге дейiн баяу кемитiн қайсыбiр функция. Сiрә U(r) тәуелдiлiгiнiң қисығы сутегi потенциалы үшін 
 тәуелдiлiгi қисығынан төмен жатады (4.2-сурет).
тәуелдiлiгi қисығынан төмен жатады (4.2-сурет).

4.1-сурет 4.2-сурет
Сiлтiлiк металдар атомдары мен сутегi атомының құрылысындағы ұқсастыққа байланысты бұлардың энергия деңгейлерiнiң орналасуында да, спектрлерiнде де ұқсастық болады екен. Демек, сiлтiлiк элементтер атомдарының қасиеттерiн егжей-тегжейлi қарастыруға кiрiспес бұрын, сутегi атомын кванттық бейнелеуге тоқталған жөн.
| |
4.3.2. Сутегi атомын кванттық бейнелеу. Сутегi атомы үшін Шредингер теңдеуiн
 (4.1)
(4.1)
шешу мына нәтижелерге келтiредi. Бәрiнен бұрын сутегi атомының байланысқан күйлерi (E<0) En белгiлi энергия мәндерiмен дискреттi жиынтығын түзедi:
 (4.2)
(4.2)
мұндағы Rhc=13,6 эВ -сутегi атомын негiзгi күйден иондау энергиясы; R=109678 см-1-Ридберг тұрақтысы; n-бас кванттық сан, бiрден бастап барлық бүтін мәндер қабылдай алады. En энергия деңгейлерi азғындалған, яғни әрбiр деңгейге (демек, әрбiр n-бас кванттық санына) электрондық бұлт пiшiнi және электронның  орбиталық импульс моментi өзгеше болатын бiрнеше күй сәйкес келедi.
орбиталық импульс моментi өзгеше болатын бiрнеше күй сәйкес келедi.
Орбиталық момент мына заң бойынша квантталады:

 ,
,
мұндағы l-орбиталық кванттық сан: l=0, 1, 2,..., n-1. l-мәндерi әртүрлі күйлерді латын әрiптерiмен белгiлейдi:
l 0 1 2 3 4 5
күйлер s p d f g h
және осыған сәйкес s-күйлер, p-күйлер, d-күйлер және т.т. деп аталады.
l әр түрлі күйлердегi электрондық бұлттардың пiшiнi жайында жалпы көрiнiстi 4.3-суреттен көруге болады.


4.3-сурет
Суретте 2s, 2p-күйлерi үшін r және r+dr радиустары арасындағы шарлық қабаттан электронның табылу ықтималдығы тығыздығын сипаттайтын çyç2dr шамаларының графиктерi кескiнделген. Жалпы заңдылық мынадай: электрондық бұлт мөлшерi n2-қа тура пропорционал өседi және l кванттық саны өскенде атомның шеткi жағына қарай қайта үлестiрiлiнедi.
| |
4.3.3. Сiлтiлiк элемент атомдарының энергия деңгейлерi. Сiлтiлiк металл атомының стационарлық күйлерi энергияларын (4.1) Шредингер теңдеуi көмегiмен табуға болады. Бiрақ мұнда потенциалдық энергия сутегi атомындағыдай емес басқаша болады. Егер сiлтiлiк металл атомында барлығы z электрон болса оның (z-1) электроны ядромен бiрiгiп едәуiр орнықты тұлға (атомдық қалдық) құрап тұрады; ал оның электр өрiсiнде атомдық қалдықпен жеткiлiктi әлсiз байланысқан сыртқы (валенттiк) электрон қозғалады деп санауға болатындығы жоғарыда айтылған болатын. Кейбiр мағынада сiлтiлiк металл атомдары сутегi тәрiздi болғанымен бiрақ толық дәл сондай емес. Мәселе, сыртқы электронның электрондық тұлғаны бiршама деформациялап, осыдан өзi қозғалатын өрiстi бұрмалап, өзгерте алатындығында болып тұр. Бiрiншi жуықтауда атомдық қалдық (тұлға) өрiсiн оның центрiнде орналасқан +е нүктелiк заряд өрiсi мен нүктелiк диполь өрiсiнiң суперпозициясы ретiнде қарастыруға болады. Осы жағдайда диполь осi әрқашанда сыртқы электронға бағытталған болады. Сондықтан сыртқы электрон тұлға өрiсiнiң бұрмалаңдығына қарамастан сфералық-симметриялығы сақталатын өрiсте қозғалатын болады. Сонда валенттiк электрон қозғалатын поляризацияланған атомдық қалдықтың өрiсiн нүктелiк заряд өрiсiне диполь өрiсi қабаттасқан өрiс деп есептеп, потенциалдық энергияны жуық түрде былай өрнектеуге болады
 , (4.3)
, (4.3)
мұндағы (- 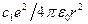 )-сiлтiлiк металл атомдары өрiсiнiң сутегi атомы өрiсiнен айырмашылығы ескерiлетiн түзету. Атомдық қалдықтың электр өрiсi сфералық-симметриялы, яғни бұрыштарға (j,q) тәуелсiз деп санауға болады. Сонда сiлтiлiк металл атомы үшін Шредингер теңдеуiнiң бұрыштық бөлiгi сутегi атомындағыдай болады. R(r) радиалдық толқындық функция үшін Шредингер теңдеуi былайша өзгередi: сутегi үшін теңдеудегi
)-сiлтiлiк металл атомдары өрiсiнiң сутегi атомы өрiсiнен айырмашылығы ескерiлетiн түзету. Атомдық қалдықтың электр өрiсi сфералық-симметриялы, яғни бұрыштарға (j,q) тәуелсiз деп санауға болады. Сонда сiлтiлiк металл атомы үшін Шредингер теңдеуiнiң бұрыштық бөлiгi сутегi атомындағыдай болады. R(r) радиалдық толқындық функция үшін Шредингер теңдеуi былайша өзгередi: сутегi үшін теңдеудегi  орнына (4.3) өрнегiн қою керек болады.
орнына (4.3) өрнегiн қою керек болады.
Сутегi атомы үшін Шредингер теңдеуi (толқындық функцияның R(r) радиалдық бөлiгi үшін) мына түрде жазылады [12]:
| |
 (4.4)
(4.4)
Осы теңдеудi сiлтiлiк металл атомы үшін жазатын болсақ, онда (4.4) теңдеудегi жақша iшiндегi екi өрнек орнына мына өрнектi алу керек болады:
 (4.5а)
(4.5а)
Егер  (4.5б)
(4.5б)
белгiлеуiн енгiзсек, онда (4.4) теңдеуi орнына соған ұқсас теңдеу алынады:
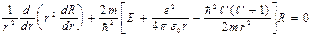 (4.6)
(4.6)
Сутегi атомы үшін (4.4) теңдеуiнiң шешiмi белгiлi. Ендi (4.6) теңдеуiнiң де шешiмi сутегi есебiнiкi сияқты болады, тек мұнда l орнына l¢-пен алмастырылған. Сонымен, сiлтiлiк металл атомының Е энергиясы үшін сутегi есебiндегiдей, бiрақ l кванттық саны l¢ санына алмастырылған өрнек алынады
 (4.7)
(4.7)
Сiлтiлiк металдар атомдарының энергия деңгейлерi (4.7) формуласының сутегi атомы үшін  формуладан өзгешелiгi, (n=n¢+l+1) бас кванттық сан орнына (n*=n¢+l+1) саны (тиiмдi кванттық сан) тұр. n* саны ендi бүтін сан емес, өйткенi (4.5б) теңдiгiмен анықталатын l¢ саны бүтін сан болмайды:
формуладан өзгешелiгi, (n=n¢+l+1) бас кванттық сан орнына (n*=n¢+l+1) саны (тиiмдi кванттық сан) тұр. n* саны ендi бүтін сан емес, өйткенi (4.5б) теңдiгiмен анықталатын l¢ саны бүтін сан болмайды:
 (4.8)
(4.8)
мұндағы Dl түзету шамасы кванттық ақау деп аталады. (4.8) бойынша l¢ мәнiн пайдаланғанда n* тиiмдi кванттық саны былай өрнектеледi:
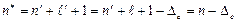 (4.9)
(4.9)
Ендi (4.7) формуласына n* мәнiн және R Ридберг тұрақтысын енгiземiз, сонда
 (4.7а)
(4.7а)
| |
Атомдық қалдықтың валенттiк электронға ұйытқытушы әсерiн Dl кванттық ақау көмегiмен ескеру орнына, оны а экрандау түзетуi арқылы да ескеруге болады. Сонда (4.7а) өрнектi мына түрде жазуға болады
 (4.7б)
(4.7б)
мұндағы  - (4.7в)
- (4.7в)
экрандау тұрақтысы, z*nl -«тиiмдi ядро» заряды.
Сонымен Е nl энергия деңгейлерi n бас кванттық санына ғана емес, l орбиталық кванттық санға да тәуелдi болып шықты. Dl кванттық ақау шамасы l-ге тәуелдi болатындықтан, n санының мәнi бiрдей, бiрақ l сандары әр түрлі деңгейлер сутегi атомында беттесiп жататын (азғындалған) болса, сiлтiлiк металдар атомдарында бұлар бiрiнен-бiрi ажырамайды. Бұл n санының бiр мәнi жағдайында энергия деңгейлерi l санының әр түрлі мәндерi үшін әр түрлі болатынын бiлдiредi. Осы жағдайда орбиталық кванттық сан бойынша азғындалу жойылды дейдi. l орбиталық кванттық сан мәнi өскенде Dl түзетуiнiң ролi әлсiрейдi (4.1-кесте). Сондықтан сiлтiлiк элемент атомы энергиясының l санының тәуелдiлiгi оның үлкен мәндерi жағдайында iс жүзінде бiлiнбейдi. Сiлтiлiк металдар атомдары үшін спектрлiк термдер
 (4.10)
(4.10)
формуласымен анықталады. Осындай формуланы Ридберг 19 ғ. тәжiрибе нәтижелерiн қорыту нәтижесiнде тапқан болатын.
4.1-кесте
Li, Na, K, Rb, Cs үшін Dl кванттық ақау мәндерi
| z, элемент | D0 ºDs | D1 ºDp | D2 ºDd | D3 ºDf |
| 3 Li | 0,412 | 0,041 | 0,002 | 0,000 |
| 11 Na | 1,373 | 0,883 | 0,010 | 0,001 |
| 19 K | 2,230 | 1,776 | 0,146 | 0,007 |
| 37 Rb | 3,1ұ5 | 2,711 | 1,233 | 0,012 |
| 55 Cs | 4,131 | 3,649 | 2,448 | 0,022 |
| |
4.3.4. Сiлтiлiк металдар спектрлерi. Сiлтiлiк металл атомдарының шығару спектрлерi, сутегi атомының спектрi сияқты, көптеген спектрлiк сызықтардан тұрады.

4.4-сурет
Осы спектрлiк сызықтарды мұқият жүйелеу нәтижесiнде бұларды әрқайсысы қоздырылған атомның қандай да бiр белгiлi деңгейге ауысуымен байланысты серияларға топтастыру мүмкін болады.
Атомның мүмкін болатын стационарлық күйлерiнiң жиынтығын энергетикалық деңгейлер диаграммасы (схемасы) түрінде кескiндеу қолданылады. 4.5-4.7-суреттерде Li, Na, K атомдарының энергетикалық деңгейлер диаграммалары келтiрiлген. Бұларда электрон бiр энергетикалық күйден басқасына ауысқан кезде атом шығаратын немесе жұтатын кейбiр спектрлiк сызықтардың толқын ұзындықтары көрсетiлген.
Сiлтiлiк металдар иондарының спектрлерiн зерттеу атомдық қалдықтың (яғни ядро және (z-1) электронның) импульс моментi нөлге тең  болатынын көрсеттi. Демек, сiлтiлiк металл атомының орбиталық моментi оның сыртқы электронының моментiне тең болады және l кванттық санымен анықталады:
болатынын көрсеттi. Демек, сiлтiлiк металл атомының орбиталық моментi оның сыртқы электронының моментiне тең болады және l кванттық санымен анықталады:  .
.
| |
Dl=±1 (4.11)
жағдайлардағы ауысулар ғана екен. Бұл ұрықсат етiлген ауысулар тек s-және p-күйлер арасында, p-және d-күйлер арасында d-және f-күйлер арасында болады деген мағына бередi. Бұл жағдайларда n бас кванттық сан кез-келген бүтін санға өзгере алады.
Кванттық теория тұрғысынан сұрыптау ережелерi бiр кванттық күйден басқа бiр кванттық күйге ауысу ықтималдығымен байланысты болады. Сонда сұрыптау ережелерi тиым салатын ауысулардың ықтималдығы iс жүзінде нөл болады екен.
Спектрлiк сериялар. (4.4) сұрыптау ережелерiне сүйенiп литий атомдары спектрiнде мына сериялардың байқалатындығын оңай түсіндiруге болады:
–бас серия: 
–айқын серия: 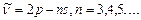

| |

4.6-сурет

| |
–диффузиялық серия: 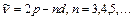 (4.12)
(4.12)
–iргелi, немесе
Бергман сериясы: 
мұндағы  -шығарылатын сызықтың толқындық саны. Бас серияның
-шығарылатын сызықтың толқындық саны. Бас серияның  ауысуына сәйкес келетiн спектрлiк сызығының интенсивтiгi ең жоғары болады. Осы сызықты резонанстық деп атайды.
ауысуына сәйкес келетiн спектрлiк сызығының интенсивтiгi ең жоғары болады. Осы сызықты резонанстық деп атайды.
(4.12) өрнектерiнде сериялар символдық түрде жазылған. Айқын түрде бұларды екi тиiстi термнiң айрымы түрінде жазады. Мәселен, литийдiң бас сериясы былай жазылады:
 , n=2, 3, 4,... (4.13)
, n=2, 3, 4,... (4.13)
Басқа серияларды да осы сияқты жазуға болады. Ескеретiн нәрсе, Dl кванттық ақау (немесе ридбергтiк түзетулер Dl =-se ) әрбiр серия аумағында iс жүзінде тұрақты болады да, ал бiр сериядан басқа серияға ауысқанда өзгередi.
Дата добавления: 2014-10-31; просмотров: 169; Мы поможем в написании вашей работы!; Нарушение авторских прав |