
КАТЕГОРИИ:
АстрономияБиологияГеографияДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРиторикаСоциологияСпортСтроительствоТехнологияФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
ОСНОВНЫЕ ЗАКОНЫ И ПОНЯТИЯ ХИМИИ
Все законы химии базируются на атомно-молекулярном учении, в связи с чем основополагающими понятиями в химии являются понятия атома и молекулы.
Атомом называется мельчайшая частица химического элемента, сохраняющая его химические свойства.
Атом каждого элемента состоит из ядра, масса которого складывается из определенного количества протонов и нейтронов, и вращающихся вокруг него электронов, число которых равно числу протонов, т.е. заряду ядра. Заряд ядра равен порядковому номеру элемента в Периодической системе Д.И. Менделеева и является величиной, определяющей химические свойства элемента. Например, порядковый номер цинка – 30, это означает, что ядро его атома содержит 30 протонов, заряд ядра равен +30, число электронов в атоме цинка – тридцать. Атомы, обладающие одинаковым зарядом ядра (и, следовательно, тождественными химическими свойствами), но разным числом нейтронов, называются изотопами.
Элементом называется вид атомов, характеризующихся определенной величиной положительного заряда ядра.
Все открытые на Земле элементы систематизированы в таблице Д.И. Менделеева. Они подразделяются на металлы и неметаллы. Каждый элемент имеет свое название и символ (например, Na – натрий, Р – фосфор).
Все вещества делятся на простые и сложные. Для большинства из них мельчайшей частицей является молекула, которая состоит из атомов, число которых и взаимное расположение в молекуле определяют свойства вещества.
Молекула – это наименьшая частица вещества, обладающая его химическими свойствами.
Молекулы могут состоять из атомов одного или нескольких элементов.
Простое вещество – это вещество, состоящее из атомов одного элемента.
Мельчайшей частицей, сохраняющей свойства простого вещества, может быть атом, а может быть молекула. Например, простое вещество железо состоит из атомов элемента железа, а простое вещество – из двухатомных молекул, образованных атомами одного элемента - кислорода.
Атомы одного и того же элемента могут образовывать несколько простых веществ, различных по своим свойствам. Это явление называется аллотропией, а вещества – аллотропическими модификациями. Аллотропические модификации отличаются друг от друга либо различным числом атомов в молекуле, например, кислород О2 и озон О3, либо разной кристаллической структурой, например, углерод, алмаз и карбин, химический знак которых – С.
Сложное вещество, или соединение, - это вещество, состоящее из атомов разных элементов.
Вид и число атомов в молекуле вещества изображаются химической формулой. Например, формула серной кислоты – H2SO4. Это означает, что молекула этого вещества состоит из одного атома серы, двух атомов водорода и четырех атомов кислорода. Соотношение между числом атомов разных элементов в молекуле определяется валентностью этих элементов.
Валентность элемента – это способность его атомов соединяться с другими атомами в определенных соотношениях.
Валентность – сложное понятие, его современное значение будет выяснено при изучении теории строения вещества.
Наряду с валентностью употребляется понятие степень окисления.
Степень окисления – это условный заряд атома данного элемента в соединении, вычисленный, исходя из предположения, что все атомы в молекуле ионизированы, т.е. имеют заряд.
Степень окисления может иметь положительное, отрицательное и нулевое значения, которые обычно ставятся над символом элемента сверху. Например,  ,
, 
 . Степень окисления элементов в простых веществах равна нулю
. Степень окисления элементов в простых веществах равна нулю  Степень окисления некоторых элементов в их соединениях имеет постоянное значение. К таким элементам относятся щелочные металлы (степень окисления +1), металлы II А подгруппы Периодической системы (+2), а также серебро
Степень окисления некоторых элементов в их соединениях имеет постоянное значение. К таким элементам относятся щелочные металлы (степень окисления +1), металлы II А подгруппы Периодической системы (+2), а также серебро  , цинк
, цинк  , кадмий
, кадмий 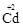 , алюминий
, алюминий  . Водород проявляет степень окисления +1 во всех соединениях, кроме гидридов, в которых степень окисления водорода равна –1
. Водород проявляет степень окисления +1 во всех соединениях, кроме гидридов, в которых степень окисления водорода равна –1 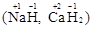 . Степень окисления кислорода практически постоянна и составляет –2.
. Степень окисления кислорода практически постоянна и составляет –2.
Большинство элементов имеет переменную степень окисления, например,  .
.
Массы атомов и молекул очень малы (10-25-10-20) и пользоваться ими при расчетах неудобно. Поэтому в химии введены относительные величины масс атомов и молекул, которые называются атомными или соответственно молекулярными массами. В качестве единицы измерения принята атомная единица массы (сокращенно а.е.м.), равная 1/12 массы атома изотопа углерода 12С.
Относительной атомной массой (или атомной массой) элемента называется масса его атома, выраженная в атомных единицах массы.
Атомные массы элементов определяются из таблицы Д.И. Менделеева, причем их значения принято округлять до целого числа. Исключение составляет масса хлора, равная 35,5.
Относительной молекулярной массой (или молекулярной массой) простого или сложного вещества называется масса его молекулы, выраженная в атомных единицах массы.
Атомные и молекулярные массы обычно приводятся без обозначения единицы измерения.
Важнейшей количественной единицей в химии является величина, называемая молем.
Моль – это количество вещества, содержащее столько молекул, атомов, ионов или других структурных единиц, сколько содержится атомов в 12 г изотопа углерода 12С.
В одном моле любого вещества содержится 6,02×1023 структурных единиц. Число 6,02×1023 называется числом Авогадро. ¥
Применяя понятие «моль», необходимо в каждом конкретном случае указывать, какие именно структурные единицы имеются в виду. Например, следует различать моль атомов Н, моль молекул Н2, моль ионов Н+. В моле атомов, молекул, ионов водорода содержится 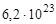 атомов, молекул, ионов водорода соответственно.
атомов, молекул, ионов водорода соответственно.
Масса 1 моль вещества называется молярной (или мольной) массой и выражается в г/моль.
Численно масса 1 моль любых структурных единиц равна массе этой структурной единицы, выраженной в а.е.м.
Одним из важнейших законов химии является закон постоянства состава.
Всякое химически чистое индивидуальное вещество, независимо от способа его получения, имеет постоянный качественный и количественный состав.
Исходя из представлений атомно-молекулярной теории это означает, что каждое химически чистое вещество состоит из одинаковых молекул, в состав которых входят атомы определенных элементов. При этом соотношение между числом атомов каждого элемента и, следовательно, соотношение между их массами определяются молекулярной формулой вещества и остаются постоянными независимо от количества вещества и способа его получения.
Вещества способны вступать между собой в химические реакции.
Процессы, при которых одни вещества превращаются в другие, отличающиеся от исходных своим составом и свойствами, называются химическими.
В основе химических процессов (реакций) лежит закон сохранения массы вещества.
Масса веществ, вступающих в химическую реакцию, равна массе веществ, образующихся в результате реакции.
Этот закон является частным случаем основополагающего закона природы – закона сохранения материи.
Закон сохранения массы вещества в химии выражается в составлении уравнения реакции, которое показывает, какие вещества и в каком количественном соотношении участвуют в данном процессе.
Химическое уравнение состоит из двух частей, соединенных знаком равенства. В левой части записываются формулы веществ, вступающих в реакцию, а в правой – формулы веществ, образующихся в результате реакции, согласно закону сохранения массы вещества. Число атомов каждого элемента в левой и правой частях уравнения должно быть одинаковым. Для этого в случае необходимости подбирают и расставляют перед формулами исходных и конечных веществ коэффициенты, которые называются стехиометрическими коэффициентами.
Так, уравнение взаимодействия гидроксида алюминия с серной кислотой

после подбора коэффициентов будет выглядеть следующим образом:
 (1)
(1)
Коэффициенты в обеих частях уравнения химической реакции можно увеличивать или уменьшать в одинаковое число раз. Так, уравнение (1) можно записать следующим образом:

Примем n равным: а)2; б)1/2. Тогда уравнение (1) будет иметь вид
а) 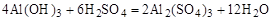 (2)
(2)
б) 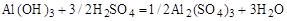 (3)
(3)
Все записанные уравнения удовлетворяют закону сохранения массы вещества.
Обычно расставляют минимальные целочисленные коэффициенты, причем коэффициент 1 опускается. В рассмотренном примере таким уравнением является уравнение (1). Уравнение реакции считается составленным только тогда, когда подобраны коэффициенты. Если при подборе коэффициентов не удается уравнять количество атомов в обеих частях уравнения, то это означает, что вещества, участвующие в реакции, написаны неправильно.
Химические уравнения можно складывать и вычитать как обычные алгебраические уравнения, если продукты одной реакции являются исходными веществами для другой. В этом случае расставляются удобные для сложения или вычитания коэффициенты.
Так, чтобы составить суммарное уравнение получения фосфорной кислоты из фосфора, кислорода и воды, надо составить два уравнения:
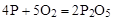 а)
а)
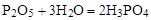 б)
б)
Чтобы исключить промежуточное вещество  , надо удвоить коэффициенты в уравнении б) и сложить оба уравнения
, надо удвоить коэффициенты в уравнении б) и сложить оба уравнения
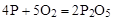
+

______________________

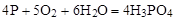
Если в реакции участвуют газообразные вещества, то на основании уравнения реакции можно определить не только массы реагирующих газов, но их объемы. Объем газа зависит от его количества, давления и температуры.
Количественные расчеты объемов газообразных веществ, участвующих в химической реакции, базируются на законе Авогадро.
В равных объемах любых газов, взятых при одинаковой температуре и давлении, содержится одно и то же число молекул.
В соответствии с законом Авогадро одинаковое число молекул газа занимает при одних и тех же условиях одинаковый объем. С другой стороны, 1 моль любого вещества содержит (по определению) одинаковое число частиц. Отсюда следует важный вывод (следствие из закона Авогадро):
При определенных температуре и давлении 1 моль любого вещества в газообразном состоянии занимает один и тот же объем.
Поскольку объем данной массы газа зависит от давления и температуры, то при расчетах по химическим реакциям с участием газообразных веществ необходимо указывать условия, при которых находится газ. Наиболее употребительными являются так называемые «нормальные» условия (н.у.). К нормальным условиям относятся: температура 00С (273К) и давление, равное 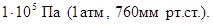
Объем 1 моль любого газообразного вещества при нормальных условиях (н.у.) равен 22,4л.
Этот объем называется молярным или мольным объемом газа при нормальных условиях.
Вещества, способные распадаться в растворе или в расплаве на заряженные частицы (ионы), называются электролитами.
Положительно заряженные ионы называются катионами, а отрицательно заряженные – анионами.
Катионами являются ионы водорода, Н+, ион аммония, NН+4, ионы металлов, например, Na+, Ca2+, Al3+. К анионам относятся гидроксид-ион, ОН-, ионы кислотных остатков, например, Cl- , NO3-, SO42-.
Свойства ионов резко отличаются от свойств атомов соответствующих элементов. Так, натрий и калий разлагают воду с выделением водорода, а ионы Na+ и K+такими свойствами не обладают.
Процесс распада молекул электролитов на ионы называется электролитической диссоциацией.
Электролитическая диссоциация является обратимым процессом, т.е. в растворе или расплаве одновременно протекают две реакции: распад молекул на катионы и анионы (КА® К++ А-) и ассоциация (соединение) ионов в молекулы (К+ + А- ® КА). Поэтому уравнение реакции электролитической диссоциации записывается следующим образом: КАÛК++А-; знак Û указывает на обратимость процесса.
Поскольку электролитическая диссоциация – процесс обратимый, то в растворах электролитов одновременно присутствуют не только ионы, но и молекулы, не распавшиеся на ионы. Способность молекул данного электролита диссоциировать в растворе или расплаве характеризуется степенью диссоциации a.
Степенью диссоциации называется отношение числа молекул (молей) электролита, распавшихся на ионы, к общему числу его молекул (молей). Степень диссоциации выражается либо в долях единицы, либо в процентах.
Все электролиты подразделяются на сильные и слабые. Сильные электролиты диссоциируют практически нацело, степень их диссоциации близка к единице (100%). В растворах сильных электролитов содержатся преимущественно ионы, недиссоциированных молекул практически нет.
Слабые электролиты характеризуются малой степенью диссоциации, поэтому в растворе присутствует значительное количество непродиссоциированных молекул.
К электролитам относятся кислоты, основания и соли.
Кислотами называются электролиты, при диссоциации которых в качестве катионов образуются только ионы водорода. Образовавшийся при диссоциации кислоты анион называется кислотным остатком.
Так, при диссоциации азотной кислоты (HNO3) образуются ион водорода Н+ и анион NO3- (нитрат-ион)
HNO3Û Н++ NO3-.
Кислоты делятся на кислородосодержащие и бескислородные. Например, серная (H2SO4) и азотная (HNO3) кислоты – кислородосодержащие, а соляная (HCl) и сероводородная (H2S) – бескислородные.
Кислоты различают по основности. Основность кислот определяется числом атомов водорода, способных замещаться на металл.
Кислоты бывают разной силы, что характеризуется их степенью диссоциации. У сильных кислот степень диссоциации близка к единице, а у слабых – значительно меньше единицы.
Слабые кислоты диссоциируют ступенчато. Например, угольная кислота диссоциирует в две ступени:

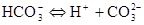
Названия кислотных остатков, полученных при ступенчатой диссоциации кислот, образуются прибавлением приставки гидро- или дигидро- (по числу оставшихся в анионе ионов водорода) к названию кислотного остатка, полученного при полной диссоциации кислоты. Например, ион СО32- называется карбонат-ионом, а ион НСО3- - гидрокарбонат-ионом, ион РО43- называется фосфат-ионом (или ортофосфат-ионом), ион HPO42- – гидрофосфат-ионом, а ион Н2РО4- - дигидрофосфат-ионом).
В таблице приведены формулы и названия некоторых кислот и их кислотных остатков.
Таблица
Формулы и названия кислот и кислотных остатков
| Формула кислоты | Название кислоты | Кислотный остаток (анион) | Название аниона |
| HCl | Сильные кислоты Соляная (хлористо-водородная) | Cl- | Хлорид |
| HBr | Бромисто-водородная | Br- | Бромид |
| HJ | Йодисто-водородная | J- | Иодид |
| HNO3 | Азотная | NO3- | Нитрат |
| H2SO4 | Серная | SO42 HSO4- | Сульфат Гидросульфат |
| HF | Слабые кислоты Фтористо-водородная | F- | Фторид |
| HNO2 | Азотистая | NO2- | Нитрит |
Формулы и названия кислот и кислотных остатков
| H2S | Сероводородная | S2- HS- | Сульфид Гидросульфид |
| H2SO3 | Сернистая | SO32- HSO3- | Сульфит Гидросульфит |
| H2CO3 | Угольная | CO32- HCO3- | Карбонат Гидрокарбонат |
| H2SiO3 | Кремниевая | SiO32- HSiO3- | Силикат Гидросиликат |
| H3PO4 | Ортофосфорная(фосфорная) | PO43- HPO42- H2PO4- | Фосфат Гидрофосфат Дигидрофосфат |
Основаниями называются электролиты, при диссоциации которых в качестве анионов образуются только гидроксид-ионы (ОН-).
Основания имеют формулу Me(OH)n, где Ме - ион металла; ОН- - гидроксильная группа; n - количество гидроксильных групп, численно равное заряду иона металла (n+), например, K+OH,Ca2+(OH)2.
Запишем уравнение диссоциации основания на примере КОН
КОНÛК++ОН-
Названия гидроксидов образуются из слова гидроксид и названия металла: NaOH - гидроксид натрия, Ba(OH)2 - гидроксид бария. Если металл имеет переменную степень окисления, то в скобках указывается римской цифрой степень окисления металла в данном основании: Fe(OH)2 - гидроксид железа (П), Fe(OH)3 - гидроксид железа (Ш). Некоторые гидроксиды имеют специфические названия, например, гидроксид калия - едкое кали, гидроксид натрия - едкий натр, гидроксид кальция - гашеная известь.
Число гидроксильных групп в формуле основания определяет его кислотность. Например, NH4OH - однокислотное основание, Cu(OH)2 - двухкислотное.
Названия катионов, содержащих, кроме металла, гидроксильные ионы. образуются из названия металла с прибавлением приставки гидроксо-, причем, если в состав катиона входят две гидроксогруппы, то название будет включать приставку дигидроксо-. Так, катион, образующийся на первой стадии диссоциации гидроксида алюминия, Al(OH)2+, называется ионом дигидроксоалюминия, а катион, образующийся на второй стадии, Al(OH)2+ - ионом гидроксоалюминия.
Основания подразделяются на растворимые и нерастворимые, а также сильные и слабые. Так, все гидроксиды 1А группы Периодической системы элементов Д.И. Менделеева, например, NaOH, KOH, а также гидроксиды щелочно-земельных металлов, Ca(OH)2, Sr(OH)2, Ba(OH)2 - хорошо растворимые соединения и сильные электролиты. Они называются щелочами. Большинство гидроксидов других металлов плохо растворяются в воде и являются слабыми электролитами. Гидроксид аммония, NH4OH, диссоциирующий по уравнению NH4OH Û NH4++OH-, является слабым электролитом, но хорошо растворим в воде.
Существуют гидроксиды, способные проявлять как свойства кислот, так и свойства оснований. Такие гидроксиды называются амфотерными. К ним относятся, например, Be(OH)2, Zn(OH)2, Al(OH)3, Cr(OH)3 и др.
Солями называются электролиты, полученные при замещении ионов водорода в кислоте на ионы металла или гидроксид-ионов основания на анионы кислотного остатка.
При полном замещении образуются средние соли, например, K2SO4, Al(NO3)3, CuCO3. Средние соли состоят из ионов металла и ионов кислотного остатка, полученного при полном отщеплении всех ионов водорода в процессе диссоциации кислоты.
Названия средних солей складываются из названия кислотного остатка и названия металла. При этом, если металл имеет переменную валентность, то она указывается римской цифрой. Например, K2SO4 – сульфат калия, Al(NO3)3 – нитрат алюминия, CuCO3 – карбонат меди (II).
При неполном замещении водорода в кислоте на металл образуются кислые соли. В этом случае кислотный остаток содержит один или два иона водорода, и соли называются в соответствии с названиями анионов, например, K2HPO4 – гидрофосфат калия, KH2PO4 – дигидрофосфат калия. Кислые соли образуют только многоосновные кислоты.
Основные соли являются продуктом неполного замещения гидроксид-ионов в основании на анионы кислотного остатка. В основных солях катион состоит из иона металла и одного или двух гидроксид-ионов. Если в состав катиона входит один гидроксид-ион, то к названию металла добавляется приставка гидроксо- , а если два, - то дигидроксо-, например CuOHCl – хлорид гидроксомеди (II), Al(OH)2NO3 – нитрат дигидроксоалюминия. Основные соли образуют только многокислотные основания.
Помимо средних, кислых и основных солей, существуют также двойные, смешанные и комплексные соли, которые в данной работе не рассматриваются.
Кислоты, основания и соли - это электролиты. К неорганическим соединениям относится еще один класс соединений, которые не являются электролитами, - оксиды.
Оксидами называются вещества, состоящие из двух элементов, одним из которых является кислород.
Примеры оксидов: NO, NO2, Mn2O7, ZnO, K2O.
Названия оксидов образуются из слова “оксид” и названия элемента, образующего оксид, с указанием степени окисления этого элемента, которая записывается в скобках римской цифрой. Так, первые три из указанных оксидов называются: NO - оксид азота (П), NO2 - оксид азота (IV), Mn2O7 -оксид марганца (VII). В названиях последних трех оксидов не указывается степень окисления элемента, поскольку она постоянна для этих элементов: Al2O3 - оксид алюминия, ZnO оксид цинка, K2O - оксид калия.
Оксиды по химическим свойствам подразделяются на солеобразующие и несолеобразующие, или безразличные. К солеобразующим оксидам относятся такие оксиды, которые при взаимодействии с кислотами или основаниями, а иногда и с кислотами, и с основаниями образуют соль. Безразличные оксиды не реагируют ни с кислотами, ни с основаниями. К ним относятся NO, N2O, CO.
Солеобразующие оксиды способны образовывать соли. Они делятся на основные, кислотные и амфотерные.
Основные оксиды - это оксиды, которым соответствуют основания.
Так, оксиду натрия соответствует основание NaOH, а оксиду кальция CaO - основание Ca(OH)2.
Кислотные оксиды – это оксиды, которым соответствуют кислоты.
Оксиду углерода (IV) - СО2 - соответствует угольная кислота Н2СО3, оксиду фосфора (V) - Р2О5 - фосфорная кислота, H3PO4.
Кислотные оксиды иначе называются ангидридами соответствующих кислот, например, Р2О5 – фосфорный ангидрид, СО2 – угольный ангидрид.
Степень окисления элемента, образующего кислотный оксид, равна степени окисления этого элемента в соответствующей кислоте. Так, степень окисления углерода в СО2 и Н2СО3 равна +4, а степень окисления фосфора в Р2О5 и Н3РО4 равна +5.
Амфотерными оксидами называются оксиды, которым соответствуют амфотерные гидроксиды, проявляющие свойства как кислоты, так и основания.
Так, оксид цинка ZnO - амфотерный оксид, ему соответствует амфотерный гидроксид Zn(OH)2, оксид хрома (III) - Cr(OH)3 - тоже амфотерен, ему соответствует амфотерный гидроксид Cr(OH)3. Амфотерные оксиды проявляют свойства как основных, так и кислотных оксидов.
Неорганические соединения (оксиды, кислоты, основания и соли) вступают в многочисленные реакции между собой, которые можно проследить на примере методов получения этих соединений.
Дата добавления: 2015-04-11; просмотров: 93; Мы поможем в написании вашей работы!; Нарушение авторских прав |