
КАТЕГОРИИ:
АстрономияБиологияГеографияДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРиторикаСоциологияСпортСтроительствоТехнологияФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Нуклеофильные реакции
Взаимодействие HD с нуклеофильными реагентами в общем виде описывается схемой:

В определенных условиях параллельно может происходить отщепление хлористого водорода, которое в неводных средах становится доминирующим.
Вещество HD достаточно устойчиво к гидролизу. Та часть его, которая растворена в воде, гидролизуется в две стадии с образованием нетоксичного тиодигликоля:

Процесс обратим, хотя, если нет большого избытка хлористого водорода, равновесие реакции (3.3) почти нацело сдвинуто вправо.
Скорость гидролиза удовлетворительно описывается уравнением первого порядка. Это дает основание считать, что в основном имеет место мономолекуляное нуклеофильное замещение атомов хлора оксигруппами. Стадией лимитирующей скорость гидролиза, является ионизация молекулы HD, обусловленная взаимным влиянием нуклеофильного и электрофильного центров этой молекулы:

Образовавшийся катион карбония, имея на атоме углерода дефицит электронов, быстро взаимодействует с нуклеофильной молекулой воды, превращаясь в β-хлор-β’-оксидиэтилсульфид:

Возможно и предварительное замыкание цикла с образованием катиона сульфония:
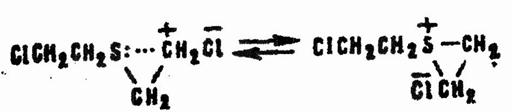
Последний устойчивее карбоний-катиона, но все равно легко реагирует с водой:

Аналогично происходят ионизация β-хлор-β'-оксидиэтилсульфоксида и замещение на оксигруппу второго атома хлора. В целом гидролиз HD в гомогенной среде может быть изображен схемой:
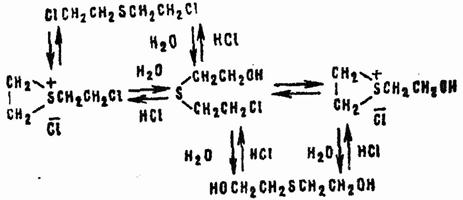
Одновременно HD взаимодействует с водой по механизму бимолекулярного нуклеофильного замещения через переходное состояние:

В полярной среде, каковой является водный раствор HD, гидролиз по этому механизму происходит в незначительной степени.
Скорость гидролиза растворенного в воде HD возрастает с увеличением температуры: при 0,6 °С половина ОВ разлагается за 3 ч, при 10 °С — за 51 мин, при 20 °С — за 10 мин, при 37 °С — за 3 мин. Полный гидролиз HD в кипящей воде происходит за 20—30 мин.
Поскольку гидролиз HD является обратимым процессом, введение кислот замедляет его. В щелочной среде скорость разложения HD увеличивается примерно на 20% по сравнению с нейтральной средой в связи с тем, что щелочь связывает выделяющийся хлористый водород и сдвигает равновесие реакции вправо. Однако водно-щелочные растворы должны быть сильно разбавленными, иначе начинает проявляться эффект высаливания HD, приводящий к уменьшению и без того небольшой его растворимости в воде. Так, гидролиз HD в 6% растворе едкого кали при температуре 50 °С происходит в три раза медленнее, чем в чистой воде.
Гидролиз ускоряется примерно вдвое при введении в воду неионогенных поверхностно-активных веществ, например эфиров полигликоля.
Добавка в воду низших алифатических спиртов, с одной стороны, способствует увеличению растворимости HD в системе и создает условия для гидролиза в гомогенной среде. С другой стороны, спирты снижают полярность раствора, подавляя ионизацию ОВ (реакция 3.4). В итоге скорость гидролиза HD при температуре 20 °С в 50% метаноле в 4 раза, в 50% этаноле — в 10 раз меньше, чем в чистой воде, а в 90% этаноле она исчезающе мала.
Очень сложны процессы, происходящие со смесями HD и воды, содержащими небольшой (не более чем 3—10-кратный) избыток воды. В этом случае система становится гетерогенной: снизу отслаивается отравляющее вещество, а над ним образуется насыщенный водный раствор этого вещества. В водной фазе HD гидролизуется в соответствии с реакциями (3.2 и 3.3). По мере снижения концентрации HD в воде и накопления тиодигликоля нерастворенное ОВ будет переходить в раствор. Таким образом, скорость гидролиза HD в гетерогенной среде лимитируется медленными процессами его диффузии и растворения в воде. В связи с тем, что в водном растворе концентрация ОВ практически не меняется, а концентрация продуктов его превращения (β-хлор-β'-оксидиэтилсульфида и тиодигликоля), смешивающихся с водой, возрастает, со временем количество молекул органических веществ становится соизмеримым с количеством молекул воды. В итоге HD и β-хлор- β'-оксидиэтилсульфид получают возможность вступать в реакции не только с водой, но и с тиодигликолем и между собой. Образуется ряд димерных и, возможно, олигомерных сульфониевых соединений, например:
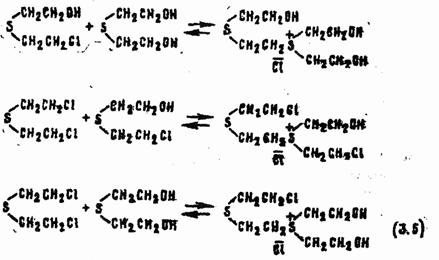
Последние при контакте с водой гидролизуются до тиодигликоля:
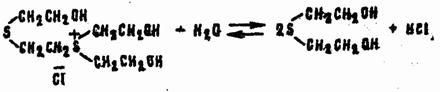
При недостатке воды возможна стабилизация сульфониевых соединений путем отщепления дихлорэтана или этиленхлоргидрина, например:

В этой сложной смеси помимо не вступившего в реакцию HD некоторые компоненты также обладают сильным кожно-нарывным действием. Так, хлористый β-(β-хлорэтилтио)-β',β''-диокситриэтилсульфоний (продукт реакции 3.5) в два раза, а 1,2-бис-(β-хлорэтилтио)этан (продукт реакции 3.6) — в 5 раз токсичнее HD. Последний рассматривался в Германии и США в качестве потенциального ОВ под названиями «Сесквииприт» («полуторный иприт») и «агент Q», однако он твердый (температура плавления 56,5 °С), и потому признан пригодным лишь для приготовления низкозамерзающей тактической смеси HQ.
Таким образом, даже длительное пребывание HD под слоем неподвижной воды не приводит к заметному снижению кожно-нарывного действия водно-ипритной смеси. Для завершения гидролиза необходимо перемешивание, кипячение в большом избытке слабощелочных водных растворов, лучше с добавдкой неионогенных моющих средств.
Вещество HD легко реагирует с гипосульфитом натрия и другими тиосульфатами в водном или водно-спиртовом растворе в присутствии протонов, которые, с одной стороны, способствуют диссоциации гипосульфита, а с другой стороны, повышают полярность связей С—С1 в отравляющем веществе вследствие возникновения водородной связи с хлором. Замещение происходит последовательно:

Аналогично реагируют с HD соли щелочных металлов низших карбоновых кислот, например:

Поскольку эти реакции происходят с количественными выходами продуктов, а ионы хлора в NaCl и КCl могут быть оттитрованы, гипосульфит натрия и ацетат калия помимо дегазации используют в аналитических целях.
Другие нуклеофильные реакции HD с водными растворами реагентов не имеют практического значения из-за низкой растворимости ОВ в воде. Исключение составляет взаимодействие с нагретым раствором сернистого натрия, продуктом которого является нетоксичный дитиан:

В спиртовых растворах HD относительно быстро реагирует с алкоголятами щелочных металлов. Реакция происходит неоднозначно. Частично имеет место нуклеофильное замещение атомов хлора:

Однако основным направлением реакции является не замещение, а отщепление хлористого водорода, приводящее к получению непредельных сульфидов:

Аналогично:

Реакции HD с алкоголятами натрия, калия или лития, образованными из низших незамещенных спиртов, а также из алкокси- и аминоспиртов, меркаптанов, фенолов, тиофенолов, лежат в основе различных дегазирующих рецептур.
Термическое разложение HD начинается примерно при температуре 170 °С, при этом образуется сложная смесь резко пахнущих продуктов различного строения, ряд которых ядовиты. Многие из них образуются за счет процессов взаимного алкилирования молекул ОВ (подобно продуктам гидролиза HD в гетерогенных условиях). Полностью HD разлагается при температуре 500 °С, Он устойчив к детонации и выдерживает кратковременное нагревание до 300 °С.
Дата добавления: 2015-04-15; просмотров: 81; Мы поможем в написании вашей работы!; Нарушение авторских прав |