
КАТЕГОРИИ:
АстрономияБиологияГеографияДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРиторикаСоциологияСпортСтроительствоТехнологияФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Дифосген

Химические названия: трихлорметиловый эфир хлоругольной кислоты; трихлорметиловый эфир хлормуравьиной кислоты; трихлорметилхлорформиат; трихлорметилхлоркарбонат; хлорангидрид трихлорметилового эфира угольной кислоты.
Условные названия и шифры: дифосген; DP (США); Perstoff (Германия); Superpalite, Diphosgen (Англия); Surpalite (Франция).
Дифосген впервые получен в 1847 г. О. Кауром (Франция). Он широко применялся в первую мировую войну в артиллерийских снарядах и минах как самостоятельно, так и в смесях с хлорпикрином и дымообразующими веществами. Первой его применила Германия в июне 1916 г. против французских войск под Верденом. В дальнейшем дифосген и тактические смеси на его основе использовались на поле боя обеими воюющими сторонами. Всего за годы первой мировой войны было произведено около 20 тыс. т дифосгена, из которых 15,6 тыс. т приходится на долю Германии.
В годы второй мировой войны дифосген продолжал оставаться на вооружении армий ведущих капиталистических государств. В бывшей фашистской Германии к 1944 г. дифосген производился на трех заводах (в Людвигсхафене, Вольфене и Урдингене) обшей мощностью около 7 тыс. т в год. Четвертая технологическая установка в Аушвице (Освенциме) с проектной годовой мощностью 7 тыс. т находилась в стадии строительства. Все заводы принадлежали концерну «И. Г. Фарбениндустри». Запас дифосгена в Германии уже на 1 мая 1943 г. составлял 5900 т. Им снаряжались как артиллерийские химические снаряды, так и химические авиационные бомбы со взрывателями ударного действия.
Под шифром DP дифосген состоял на вооружении армии США. В настоящее время он снят с вооружения и производства, однако в случае необходимости может, быть легко получен из фосгена, тем более что перед второй мировой войной он рассматривался как более перспективное ОВ, чем фосген, предназначенное для уничтожения и изнурения живой силы противника.
По действию на организм DP аналогичен веществу CG. Он вызывает токсический отек легких только при вдыхании пара, жидкое ОВ не всасывается через кожу. Признаки раздражения, возникающие при попадании DP на кожу, несущественны и не приобретают характера ожога. Пар DP вызывает слабые раздражения и дыхательных путей. Признаки отравления DP соответствуют признакам отравления фосгеном.
Порог раздражающего действия DP на глаза 0,005 мг/л, непереносимая концентрация 0,075 мг/л при одноминутной экспозиции, смертельная—0,5—0,7 мг/л при 15-минутной и 1 мг/л—при одноминутной экспозиции. Относительная токсичность при ингаляции LCτ50 3,4 мг·мин/л.
Дифосген представляет собой бесцветную легкоподвижную жидкость с запахом прелого сена или гниющих фруктов, плотность 1,6403 г/см3 при температуре 20 °С, плотность пара по воздуху 6,9. Он растворяется в воде хуже фосгена, разлагаясь при этом, но в органических растворителях, горючем и смазочных материалах растворяется хорошо. Температура кипения 128 °С, давление насыщенного пара при темперпуре 20 °С 11,2 мм рт. ст., максимальная концентрация при той же температуре 120 мг/л Вследствие меньшего по сравнению с фосгеном давления насыщенного пара, дифосген дольше сохраняет свои поражающие свойства. В то же время концентрация его, создаваемая за счет испарения, достаточна, чтобы вызвать тяжелое отравление. Дифосген замерзает при минус 57 °С.
Химические свойства DP определяются его строением как хлорангидрида и сложного эфира угольной кислоты. В большинстве случаев он ведет себя в реакциях подобно фосгену. Гидролиз при низких температурах происходит медленно, но при кипячении завершается в течение нескольких минут:

Щелочи или сода ускоряют процесс:

Реакции DP и CG с аммиаком и аминами абсолютно идентичны. Дифосген энергично взаимодействует с аммиаком с образованием мочевины; при применении концентрированной аммиачной воды экзотермичная реакция завершается в течение нескольких секунд.
При нагревании DP разлагается на две молекулы CG:
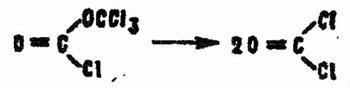
Для полного разложения требуется температура 350 °С. Однако в присутствии активированного угля, окислов алюминия и железа, хлористого олова, треххлориотого железа и треххлористого алюминия разложение происходит уже при комнатной температуре.
Защита от DP аналогична защите от CG.
Дата добавления: 2015-04-15; просмотров: 99; Мы поможем в написании вашей работы!; Нарушение авторских прав |