
КАТЕГОРИИ:
АстрономияБиологияГеографияДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРиторикаСоциологияСпортСтроительствоТехнологияФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Схема 4.2
В задаче указаны опытные данные по измерению удельной электрической проводимости χ.
1. Определяют концентрацию раствора С(г-экв/л).
2. Вычисляют эквивалентную электропроводимость λ по уравнению:
 (4.9)
(4.9)
3. Определив по табл. 4.2 подвижности соответствующих ионов, рассчитывают эквивалентную электрическую проводимость при бесконечном разбавлении по формуле:
 (4.10)
(4.10)
где l+ — подвижность катиона, l- — подвижность аниона.
4. Находят степень диссоциации вещества:
 (4.11)
(4.11)
Для растворов сильных электролитов вводится понятие кажущейся степени диссоциации αкаж или коэффициента электрической проводимости fλ= 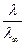 . Причем
. Причем 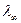 в этом случае можно определить из графика зависимости
в этом случае можно определить из графика зависимости 
Таблица 4.2
Подвижность некоторых ионов (Ом-1см2) при 250С и бесконечном разбавлении
| Катионы | l+ | Анионы | l- |
| Na+ | OH- | ||
| K+ | ½ SO42- | ||
| NH4+ | Br- | ||
| ½ Ca2+ | I- | ||
| Ag+ | Cl- | ||
| ½ Zn2+ | NO3- | ||
| ½ Mg2+ | HCO3- | ||
| H+ | CH3COO- |
Пример 4.2. Раствор, содержащий в 25 г воды 0,608 г бензойной кислоты, кипит при 100,104 °С. Эбулиоскопическая постоянная воды 0,512. Вычислите степень диссоциации бензойной кислоты в этом растворе. К слабым или сильным электролитам относится эта кислота?
Решение. Для вычислений воспользуемся схемой 4.1.
1) Молярность раствора С =  = 0,199 моль/1000 г воды,
= 0,199 моль/1000 г воды,
где 122,13 — молярная масса бензойной кислоты.
2) По формуле (4.6) ΔТКТ = 0,512 • 0,199 = 0,102 0С.
3) Согласно (4.7), i= 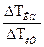 = 0,104/0,102 = 1,02.
= 0,104/0,102 = 1,02.
Учитывая (4.8), α=(1,02 -1)/(2 -1) = 0,02 или α% = 2%, следовательно, бензойная кислота является слабым электролитом.
Пример 4.3.Удельная электропроводимость 10 %-ного раствора едкого натра при 18 °С равна 0,3124 Ом--1см2, а плотность его 1,113 г/см3. Эквивалентная электропроводимость раствора данного вещества при бесконечном разбавлении равна 217,5 Ом--1см2. Вычислите кажущуюся степень диссоциации едкого натра.
Решение. Для вычислений воспользуемся схемой 4.2.
1) Концентрация раствора С =  =
=  = 2,782 г-экв/л.
= 2,782 г-экв/л.
2) По уравнению (4.9) λ =  = 112,3 Ом -1 см2.
= 112,3 Ом -1 см2.
3) По условию задачи 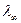 =217,5 Ом -1 см2.
=217,5 Ом -1 см2.
4) Согласно (4.11), акаж =112,3/217,5 = 0,516 или aкаж =51,6%.
Пример 4.4. Удельная электропроводимость 0,0109 М раствора аммиака равна 1,02 .10-4 Ом-1• см2. Определите рН раствора.
Решение. Определение рН раствора слабого основания возможно, если известна величина степени диссоциации (см. табл. 4.1). Для вычисления а воспользуемся схемой 4.2.
1) Концентрация раствора равна 0,0109 г-экв/л (в данном случае численно совпадает с молярной концентрацией).
2) Согласно (4.9), λ = (1,02 • 10-4 .1000)/0,0109 = 9,36 Ом-1 см2.
3) По табл. 4.2  ,
,  =205 Ом-1 см2, учитывая (4.10),
=205 Ом-1 см2, учитывая (4.10),
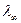 =76+ 205 = 281 Ом-1см2.
=76+ 205 = 281 Ом-1см2.
4) а= 9,36/281 = 0,033 или а% = 3,3% (см. 4.11). Согласно табл. 4.1, рН = 14+lg(0,033-0,0109) = 10,56.
Таблица 4.3
Дата добавления: 2015-04-15; просмотров: 197; Мы поможем в написании вашей работы!; Нарушение авторских прав |