
КАТЕГОРИИ:
АстрономияБиологияГеографияДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРиторикаСоциологияСпортСтроительствоТехнологияФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Энергия ионизации. Элементы, которые вступая во взаимодействие, отдают электроны на образование химической связи, обладают восстановительными свойствами и мерой их
Элементы, которые вступая во взаимодействие, отдают электроны на образование химической связи, обладают восстановительными свойствами и мерой их восстановительной способности является потенциал ионизации. Потенциал ионизации – это энергия, которую нужно затратить, чтобы «отнять» электрон от атома. Размерность эВ. эВ рассчитывают на 1 – электрон, если нужно отнять 2 электрона, то затрачивают в два раза больше энергии. Энергия ионизации (измеряется в кДж/моль или эВ) возрастает по периоду. Наименьшее значение энергии ионизации имеют щелочные металлы, находящиеся в начале периода, наибольшими значениями энергии ионизации характеризуются благородные газы, находящиеся в конце периода (рис.1.2).
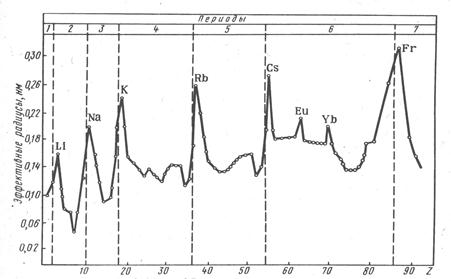
Рис. 1.1. Зависимость эффективных радиусов атомов от порядкового номера элемента

Рис. 1.2. Зависимость ионизационных потенциалов атомов
от порядкового номера элемента
Пики на кривой зависимости энергии ионизации от порядкового номера элемента наблюдаются у элементов с законченной s-подоболочкой (Ве, Мg) и d-подоболочкой (Zn, Cd, Hg) и р-подоболочкой, в АО которой находится по три электрона (N, P, As). Минимумы на кривой наблюдаются у элементов, имеющих на внешней подоболочке по одному электрону (щелочные металлы, В, Al, Ga, In).
В одной и той же группе энергия ионизации несколько уменьшается с увеличением порядкового номера элемента, что обусловлено увеличением размеров атома и расстояния внешних подоболочек от ядра.
Дата добавления: 2015-04-15; просмотров: 130; Мы поможем в написании вашей работы!; Нарушение авторских прав |