
КАТЕГОРИИ:
АстрономияБиологияГеографияДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРиторикаСоциологияСпортСтроительствоТехнологияФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Аналоги бис-2-хлорэтилового эфира
 В 1952 г. Малатеста и Д Атрии был получен бис-2-фторэтиловыйэфир тиоэфир, т. кип. 95-96 °С (30 мм рт. ст.). Точных данных о его токсичности нет. Однако можно предполагать, что его токсичность не уступает иприту.
В 1952 г. Малатеста и Д Атрии был получен бис-2-фторэтиловыйэфир тиоэфир, т. кип. 95-96 °С (30 мм рт. ст.). Точных данных о его токсичности нет. Однако можно предполагать, что его токсичность не уступает иприту.
Получают это тиоэфир с хорошим выходом (84%) обменом атомов хлора в бис-2-хлорэтиловом тиоэфире на фтор действием избытка фтористого серебра при нагревании в течении 2 ч при 40-50 °С.
S(CH2CH2Cl)2 S(CH2CH2F)2
Число других описанных фторированных тиоэфиров мало.
 После первой мировой войны бис-2-бромэтиловый тиоэфир был исследован как возможное ОВ. Во время второй мировой войны он упоминался в литературе под названием «бромлост». По свойствам он соответствует иприту. Физиологическое действие одинаково с ипритом, токсичность несколько меньше.
После первой мировой войны бис-2-бромэтиловый тиоэфир был исследован как возможное ОВ. Во время второй мировой войны он упоминался в литературе под названием «бромлост». По свойствам он соответствует иприту. Физиологическое действие одинаково с ипритом, токсичность несколько меньше.
Т. кип. 240 °С с разл. (760 мм рт. ст.), 134 °С (17 мм рт. ст.); пл. 31-34 °С; давление пара при 20 °С--0,03 мм рт. ст.; предельная концентрация при 20 °С – 0,4мг/л.
Бис-2-бромэтиловый тиоэфир получают по реакции тиодигликоля с трехбромистым фосфором или бромистым водородом.
Как ОВ бис-2-бромэтиловый тиоэфир в настоящее время в расчет не принимается.
Смешанный бромхлорид, --2-хлорэтил-2'-бромэтиловый тиоэфир, имеет т. кип. 125-132 °С (13 мм рт. ст.) т. пл. 24 °С.
Бис-2-иодэтиловый тиоэфир—желтое кристаллическое вещество, т. пл. 62-70 °С; его свойства аналогичны свойствам уже рассмотренных соединений.
2,2'-Бис-(2-хлорэтилтио)-диэтиловый эфир («кислородный иприт»)
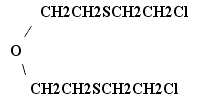 2,2'-бис-(2-хлорэтилтио)-диэтиловый эфир был получен и исследован в Англии во время второй мировой войны. Это соединение обладает значительно более сильным кожно-нарывным действием, чем иприт. В общем, его физиологическая активность примерно в 3,5 раза превышает активность иприта. Кислородный иприт предполагали применять в тактических смесях.
2,2'-бис-(2-хлорэтилтио)-диэтиловый эфир был получен и исследован в Англии во время второй мировой войны. Это соединение обладает значительно более сильным кожно-нарывным действием, чем иприт. В общем, его физиологическая активность примерно в 3,5 раза превышает активность иприта. Кислородный иприт предполагали применять в тактических смесях.
Физические свойства: т. кип. 174 °С (2 мм рт. ст.), 120 °С (0,001 мм рт. ст.); т. пл. от -30 до -38 °С.
Получение. Кислородный иприт получается при действии концентрированной соляной кислоты на тиодигликоль при 110 °С как составляющая образующейся смеси т. н. НТ (60% иприта и 40% кислородного иприта). Отделить кислородный иприт из этой смеси перегонкой невозможно.
В чистом виде кислородный иприт получают хлорированием 2,2-бис-(2-оксиэтилтио)-диэтилового эфира тионилхлоридом в растворе хлороформа при температуре ниже 40 °С.
Исходное оксисоединение получают из бис-2-хлорэтилового эфира и спиртового раствора натриевой соли 2-меркатоэтанола.
Полученный продукт плавится при 32 °С; т. кип. 215 °С (2,5 мм рт. ст.)
 Кожно-нарывное действие бис-2(-хлоэтилтио)-алканов сильнее чем у иприта.
Кожно-нарывное действие бис-2(-хлоэтилтио)-алканов сильнее чем у иприта.
По Вудворду и сотр., 1,2 бис-(2-хлорэтилтио)-этан (сесквииприт) получают взаимодействием смеси 2-меркаптоэтанола и тиодигликоля (10%) с хлористым водородом при 90 °С.
В общем эти соединения (аналоги гомологи) иприта которых известно несколько десятков можно получать, действуя на соответствующие w,w' -дибромалканы 2-меркаптоэтанолом или соответствующим тиолятом натрия с последующей обработкой бис-(2-оксиэтилтио)-алкана тионилхлоридом.
Дата добавления: 2015-04-15; просмотров: 112; Мы поможем в написании вашей работы!; Нарушение авторских прав |