
КАТЕГОРИИ:
АстрономияБиологияГеографияДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРиторикаСоциологияСпортСтроительствоТехнологияФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
ГЛАВА 17.
Mitsuhara I,, M, Ugaki, H. Hirochika, M. Ohshima, T. Murakami, Y. Gotoh, Y. Katayosc, S. Nakamura, R. Honkura,S. Nfehimiya, K. Lcno, A. Mochizuki, H. Tanimoto, H. Tsugawa, Y. Otsuki, Y. Ohashi.1996. Efficient promoter cassettes forenhanced expression of foreigngenes in dicotyledonous and monocotyledonous plants. Plant Cell Physio!. 37:49-59.
Ow D. W., K. V. Wood, M. DeLuca, J. R. de Wet, D. R. Helinski, S. H. Howell. 1986. Transient and stable expressionof the firefly luciferase gene in plant cellsand transgenic plants. Science 234: 856-859.
Paszkowski J., M. Baur, A. Bogucki, I, Potrykus,1988. Genetargeting in plants. EMBO J. 7:4021-4026.
Pausl K. P. 1995. Plant biotechnology for cropimprovement. B'totechnol. Adv. 13:673—693.
Potrykus 1. 1990. Gene transfer to cereals: anassessment. Bio/Technology 8:535-542.
Potrykus 1.1991. Genetransfer to plants: assessment of published approaches and results.Anna. Rev.riant Physiol.41: 205-225.
Southgate E. M., M. R. Davey, J. B. Power, R. Marchant1995. Factors affecting the geneticengineering of plants by microprojectilebombardment. Riotectinoi. Adv.13:631—651.
Vain P., J. de Buyser, V. Bui Trang, R. Haicour, Y. Henry.1995. Foreign delivery into monocotyledonousspecies, fiiotechnol. Adv. 13:653—671.
Waiden R., J. Shell.1990. Techniques in plant molecular biology—progress and problems. Ear. J. Biochem. 192: 563-576.
Waiden R., R. Wingender. 1995. Gene-transfer and plant-rege ne rationtechniques. Trends Kotechnol. 13:324-331.
Voder J. 1., A. P. Goldsbrough. 1994. Transformation
system for generatingmarker-free transgenic
Plants.Bio/Technology 12: 263-267. Zambryski P.1988. Basic processes underlying
Agrobacterium-meàtateà DNA transferto plant
cells. Antw. Rev. Genet, 22: 1-30. Zambryski P., J. Tempe, J. Schell.1989. Transfer
And functionof T-DNAgenes from
Agrobacterium Tiand Ri plasmids in plants. Cell
56: 193-201.
КОНТРОЛЬНЫЕ ВОПРОСЫ
1. Почему Ti-плазмида из Agrobacterium tumefaciens подходит для создания вектора — переносчика чужеродного гена в хромосомную ДНК растения?
2. Чем различаются бинарная и коинтегративная векторные системы?
3. Что такое репортерные гены и как они используются при трансформации растительных клеток?
4. В чем заключается метод бомбардировки клеток микрочастицами, использующийся для трансформации растений?
5. Подробно опишите, как вы будете выделять растительный промотор, специфичный для тканей корней.
6. Как интегрировать чужеродный ген в ДНК хлоропластов?
7. Как получить трансгенное растение, не содержащее маркерного гена?
8. Как повысить активность растительного промотора?
ГЛАВА 18.
Генная инженерия растений: применение
Основной целью биотехнологических экспериментов на растениях является создание новых сортов культурных растений. Большинство ранних исследований было направлено на получение высокоурожайных сортов растений без изменения их пищевой ценности. В растения вводили гены, обеспечивающие их устойчивость к насекомым-вредителям, вирусам, гербицидам, неблагоприятным условиям окружающей среды, и гены, замедляющие старение. Часть этих работ мы рассмотрим ниже. Кроме того, проводились эксперименты по изменению окраски цветов и качества растительных продуктов, а также по использованию растений в качестве «биореакторов".
Выведение растений, устойчивых к насекомым-вредителям, вирусам и гербицидам
Растения, устойчивые к насекомым-вредителям
Если бы хлебные злаки можно было изменять методами генной инженерии так, чтобы они продуцировали функциональные инсектициды, то мы получили бы культуры, устойчивые к насекомым-вредителям и не требующие опрыскивания дорогостоящими и опасными химическими пестицидами (зачастую такое опрыскивание приходится проводить от шести до восьми раз в течение вегетационного периода). По оценкам, в 1995 г. на химические инсектициды во всем мире было израсходовано примерно 4 млрд. долларов. Отсюда следует, что себестоимость зерна при возделывании культур, устойчивых к насекомым-вредителям, была бы ниже, чем для неустойчивых. Кроме того, биологические инсектициды обычно действуют лишь на строго ограниченное число видов насекомых и безопасны для человека и других высших животных.
Для создания растений, устойчивых к насекомым-вредителям, с помощью генноинженерных методов были разработаны различные стратегии. В одном случае использовали ген инсектицидного протоксина, продуцируемого одним из подвидов Bacillus thuringiensis (гл. 15). В другом — гены растительных белков типа ингибиторов амилазы или протеиназ, эффективных в отношении широкого круга насекомых. Насекомое, в организм которого попадал один из этих ингибиторов, было не способно переваривать растительную пищу, потому что ингибиторы препятствовали гидролизу крахмала или растительных белков.
Протоксин В. thuringiensis — это безопасное средство защиты растений: попадая в окружающую среду, он теряет активность. К сожалению, множество вредителей хлебных злаков питаются внутренними тканями растения, так что препараты В. thuringiensis, распыляемые на поверхность растений, оказываются малоэффективными. Эту проблему можно решить, если обеспечить экспрессию генов токсинов в самих растениях. Распылять инсектициды в этом случае не потребуется и токсины не попадут в окружающую среду, а кроме того, не возникнет проблем, связанных с ограничением времени их действия в результате разложения. Задача биотехнологов состоит в создании трансгенного растения, которое синтезировало бы активную форму бактериального инсектицида в количестве, достаточном для защиты растения от вреди-
390 ГЛАВА 18
| Таблица 18. L Экспрессия некоторых генов, кодирующих инсектициды ßacillus thuringiensis в трансгенных растениях 1) 2) | |||
| Растение | Ген | Экспрессия % | Устойчивость к насекомым |
| Табак | 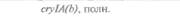
| 
| Нет |
| Табак | 
| 
| Да |
| Табак | 
| 
| Нет |
| Табак | 
| 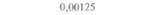
| Да |
| Табак | 
| 
| Да |
| Томат | 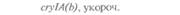
| 
| Да |
| Хлопок | 
| 
| Нет |
| Хлопок | 
| 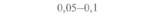
| Да |
| Томат, табак | 
| 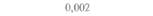
| Да |
| Томат, табак | 
| 
| Да |
| Томат, табак | 
| 
| Да |
| 1) По данным работы Ely, p. 105- 124, in Entwistle et al. (ed)., Bacillus thuri ngteniii, an Environmental Biopesticide: Theory and Practice, 1493. | |||
| 2) Обозначения: полн. — полноразмерный ген протоксина; укороч. — укороченная версия гена протоксина; WT — кодоны дикого типа; РМ — частично измененные кодоны; FM — полностью измененные кодоны. |
теля. Гены cryIA(a), cryIA(b) и сryIА(с), ответственные за синтез инсектицидных белков В. thuringiensis ssp, kurstaki, практически не экспрессируются в растениях (табл. 18.1), а для выведения представляющих коммерческий интерес жизнеспособных растений, устойчивых к насекомым-вредителям, необходимо, чтобы эти белки синтезировались в большом количестве. Пытаясь решить эту проблему, уменьшили размер встроенного гена так, чтобы синтезировалась только N-концевая часть молекулы токсина, и снабдили его сильным растительным промотором, чтобы повысить уровень экспрессии. Количество синтезируемого токсина при этом значительно увеличилось, и трансгенные растения получили некоторую защиту от насекомых-вредителей.
Далее была поставлена задача найти минимальную длину нуклеотидиной последовательности, обеспечивающей активность токсина. Чтобы определить, есть ли у разных токсинов одинаковый домен, сравнили аминокислотные последовательности протоксинов, продуцируемых различными штаммами B. thuringîensis. Оказалось, что N-концевой участок молекул протоксинов разных штаммов В. thuringiensis ssp. kurstaki высококонсервативен (гомология 98%), а С-концевой более вариабелен (гомология 45%). Дальнейшие исследования показали, что вся инсектицидная активность токсина обеспечивается первыми 646 N-концевыми аминокис-
лотными остатками молекулы протоксина, общая длина которой составляет 1156 аминокислот. Участок гена протоксина, кодирующий высококонсервативную аминокислотную последователь, клонировали, экспрессировали в бактериях и обнаружили, что в отношении защиты растений от насекомых отряда чешуекрылых в лабораторных условиях укороченный белок столь же эффективен, как и его нативная форма.
Для всестороннего изучения способности укороченного гена протоксина обеспечивать защиту растений от различных насекомых-вредителей были выведены трансгенные растения томата. Укороченный ген, снабженный сильным конститутивным 35S-промотором вируса мозаики цветной капусты и сайтом терминации транскрипции/полиаденилирования гена нопа-линсинтазы, клонировали в Т-ДНК коинтегративного Ti-плазмидного вектора (рис. 18.1). Вектор содержал также: 1) ген устойчивости к спектиномицину (Spcr), позволяющий проводить отбор либо в Е. coli, либо в A. tumefaciens; 2) сайт инициации репликации Е. соli; 3) ген неомицинфосфотрансферазы под контролем промотора и сайта терминации транскрипции/полиаденилирования гена нопалинсинтазы, позволяющий проводить отбор трансформированных растительных клеток в присутствии канамицина. Кроме того, коинтегративный вектор содержал правую фланкирующую последовательность Т-ДНК нопалиновой Ti-плазмиды и
Генная инженерия растений: применение 391

| Рис. 18.1. Коинтегративный клонирующий вектор, несущий ген инсектицидного токсина В. thuringiensis (B.t.). Ген находится под контролем сильного конститутивного 35S-промотора (p35S) вируса мозаики цветной капусты и сайта терминации транскрипции/полиаденилирования гена нопалинсинтазы (tNOS). Вектор содержит также: сайт инициации репликации Е. coli (ori) и ген устойчивости к спектиномицину (Spcr), что обеспечивает его амплификацию в E. coli и позволяет проводить отбор соответствующих клеток; правую фланкирующую последовательность Т-ДНК; растительный селективный маркерный ген; последовательность, гомологичную неонкогенной Τi-плазмиде и обеспечивающую интеграцию двух плазмид. Ген неомицинфосфотрансферазы (NPT) находится под контролем элементов регуляции транскрипции гена нопалинсинтазы (pNOS и tNOS) и используется для отбора канамицинустойчивых трансформированных растительных клеток. |
сегмент октопиновой Ti-плазмиды, обеспечивающий образование коинтеграта с «разоруженной» Ti-плазмидой с помощью гомологичной рекомбинации. Сконструированной плазмидой трансформировали Е. соli, а затем с помощью конъюгации перенесли ее в штамм A. tumefaciens, содержащий «разоруженную» Ti-плазмиду. После рекомбинации в A. tumefaciens укороченный ген протоксина включался в хромосомную ДНК томата.
И в оранжерее, и при полевых испытаниях трансгенные растения томата, которые синтезировали укороченную форму протоксина, проявляли некоторую защищенность от таких насекомых, как бражник (Manduca sexta), совка, повреждающая плоды томата (Heliothis zea), выемчатокрылая моль (Keiferia lycopersicella) (табл. 18,2), Эффект был неодинаков для разных насекомых и не абсолютен: наиболее выражен он был в первых двух случаях. Иногда хороший результат давала обработка растений, синтезирующих про-токсин, химическим инсектицидом в низких дозах. Однако для того чтобы определить, как еще больше уменьшить ущерб, причиняемый указанными выше и другими насекомыми-вредителями, необходимы дальнейшие исследования,
Для кардинального повышения уровня экспрессии использовались два других подхода (табл. 18.1). В первом случае методом сайт-специфического мутагенеза изменяли те участки выделенного гена токсина, которые могли бы быть ответственны за снижение эффективности транскрипции или трансляции в растении-хозяине (в этих экспериментах использовали и табак, и томаты). При этом нуклеотидная последовательность измененного гена на 96,5% совпадала с таковой у гена дикого типа. Трансгенные растения, в которых экспрессировался такой "слабо» модифицированный ген, синтезировали в 10 раз больше токсина, чем растения, трансформированные геном дикого типа.
Во втором случае была разработана и синтезирована химическими методами «полностью»
| Таблица 18.2. Чувствительность трансгенных растений томата и растений дикого типа к насекомым-вредителям '' | ||||
| Насекомое | Доля поврежденных растений или плодов, % | |||
| растения дикого типа | трансгенные растения | |||
| без инсектицида | с инсектицидом | без инсектицида | с инсектицидом | |
| Бражник | 47,5 | 3,75 | 1,25 | 0,00 |
| Совка | 20,1 | Не определяется | 6.4 | Не определяется |
| Выемчатокрылая моль | 99.7 | 95,1 | 94.2 | 80,4 |
| 1) По данным работы Delannay et al., Bio/Technology 7: 1265-1269, 1989. |
Дата добавления: 2015-04-16; просмотров: 67; Мы поможем в написании вашей работы!; Нарушение авторских прав |