
КАТЕГОРИИ:
АстрономияБиологияГеографияДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРиторикаСоциологияСпортСтроительствоТехнологияФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
E. M. Donaldson, P.Swanson, W.-K. Chan. 4 страница
цах, которые отражают частоту рекомбинации (сМ) или вероятность сохранения двух сайтов в одном радиационном гибриде (сР). Эти единицы можно перевести (в некотором приближении) в единицы реальных физических расстояний — пары нуклеотидов, которые используются в физических картах. Физическая карта целой хромосомы или ее области дает непосредственное представление о расположении генов в ДНК, что облегчает их идентификацию и характеристику и систематическое секвенирование хромосомной ДНК.
Для построения физической карты необходимо прежде всего выделить из библиотеки геномной ДНК клоны, содержащие перекрывающиеся сегменты. Исходя из данных о перекрывающихся участках и другой информации о положении клонов, можно реконструировать непрерывный ряд клонированных сегментов какого-то района хромосомы, целой хромосомы или всего генома. Были получены упорядоченные наборы смежных (contiguous) клонов (контиги) на основе YAC-(yeast artifitial chromosome, искусственная хромосома дрожжей), В AC-(bacterial artifitial chromosome, искусственная хромосома бактерий), PAC-(bacterio-phage PI artifitial chiomosome, искусственная хромосома бактериофага Р1) и космидных библиотек ДНК человека. Отметим, что стратегия построения контигов из крупных фрагментов ДНК человека, содержащихся в YAC-, ВАС- или PAC-библиотеках, немного отличается от таковой для Р1- или космидных контигов,
Построение контигов из YAC-, ВАС-и PAC-библиотек
При построении физических карт тех или иных районов хромосом или целых хромосом из геномных библиотек, содержащих крупные вставки (YAC-, ВАС- или PAC-библиотек), наиболее приемлем метод картирования, основанный на использовании STS. STS — это короткий одно-копийный участок ДНК (примерно 100—300 п. н.), который можно выявить при помощи Π ЦР с использованием уникального набора праймеров. Для получения протяженного контига, охватывающего значительный участок хромосомы, требуется большое число STS, находящихся на расстоянии 50—100 т. п. н. друг от друга. Напри-
Молекулярная генетика человека 463
мер, для физического картирования хромосомы длиной примерно 200 миллионов пар нуклеотидов (м. п. н.) необходимо от 1500 до 3000 STS. Для построения же достаточно точной физической карты всего генома человека их нужно по меньшей мере 30 000.
Для создания STS были разработаны различные подходы. В одном из них ДНК из очищенного препарата одной хромосомы человека, изолированной при помощи проточной цитофотометрии, обрабатывают рестриктазой и клонируют в векторе, способном акцептировать небольшие (< 1000 п. н.) фрагменты ДНК. Затем секвенируют вставки из клонов, выбранных случайным образом, и отбрасывают те клоны, в которых вставки короче 100 п. н., и те, которые содержат последовательности из повторяющихся элементов ДНК человека. Наличие повторов определяют при помощи компьютерных программ, сравнивая нуклеотидную последовательность вставки с последовательностями всех известных повторов ДНК человека. Затем для каждого отобранного клона находят нуклеотидные последовательности праймеров. Каждый STS тестируют на предмет уникальности амплифицируемого фрагмента хромосомной ДНК.
С помощью ПЦР-скрининга выявляют STS в индивидуальных клонах библиотеки с крупными вставками, а затем, основываясь на распределении STS в клонах, численными методами находят вероятный набор перекрывающихся клонов и относительное положение имеющихся STS (рис. 20.18). С разработкой метода РГ-картирования появилась возможность без особого труда упорядочить STS, что облегчает идентификацию составляющих контига (рис. 20.19). Выявив перекрывающиеся клоны, определяют степень их перекрывания, размер контига и общую длину охватываемой им ДНК, с помощью эндонуклеазного картирования с использованием электрофоретической системы, разделяющей фрагменты ДНК длиннее 105 п. н. (например, импульсный электрофорез). Уже получены контиги хромосомных районов, охватываюшие от 1 до более чем 20 м. п. н., а в ряде случаев — и целые хромосомы. В конце концов будут получены контиги из крупных фрагментов ДНК, перекрывающие весь геном.
Построение контигов из космидных, P1- и λ-библиотек
Более удобными для генетических исследований и широкомасштабного секвенирования часто оказываются контиги из небольших фрагментов ДНК, чем из крупных. Для построения контигов определенных районов хромосом или целых хромосом нередко используют космид-ные библиотеки. Обычно перекрывающиеся кос-мидные клоны идентифицируют методом геномной дактилоскопии. Для этого из каждого клона экстрагируют ДН К и обрабатывают ее рестриктазой. Полученные фрагменты метят, разделяют при помощи электрофореза и визуализируют радиоавтографическими методами. Каждый клон порождает специфический набор фрагментов —уникальный отпечаток его ДНК; у перекрывающихся клонов один или несколько фрагментов совпадают.
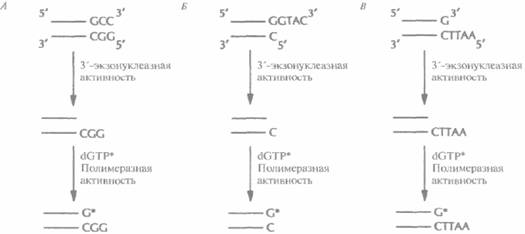
Для концевого мечения ДНК-фрагментов -независимо от характера образующихся после эндонуклеазной обработки концов (5'-, 3'-выступающих или тупых) — можно использовать реакцию замещения, катализируемого ДНК-по-лимеразой Т4. В этом случае к препарату космидной ДНК, обработанной рестриктазой, добавляют ДНК-полимеразу и один меченый дезоксинуклеотид (рис. 20.20). Под действием 3'-экзонуклеазной активности ДНК-полимеразы происходит последовательное отщепление 3'-концевых нуклеотидов. Процесс продолжается до тех пор, пока в противоположной цепи не экспонируется нуклеотид, комплементарный меченому дезоксинуклеотиду, добавленному в реакционную смесь. Далее включается полимеразная активность ДНК-полимеразы, и к 3'-концу присоединяется свободный меченый нуклеотид. Поскольку другие нуклеотиды в реакционной смеси отсутствуют, дальнейшего роста цепи не происходит.
Для мечения эндонуклеазных фрагментов существуют и другие способы. Усеченный 3'-конец фрагмента можно удлинить (достроить) при помощи фрагмента Кленова, использующего выступающий 5'-конец в качестве матрицы; достраивание осуществляется за счет добавленных в реакционную смесь дезоксирибонуклеотидов, один из которых несет метку. Кроме того, к вы-
464 ГЛАВА 20

|
| Рис. 20.18. STS-картирование. A. STS (с 1 по 15), обнаруженные с помощью ПЦР-скрининга В клонах а-е, обозначены знаком плюс (+). Буквами L и R указаны STS, находящихся на 5'- и 3 '-концах вставки (на ее левом и правом концах соответственно). Б. Идентифицировав перекрывающиеся участки, можно построить контиг из пяти клонов и карту расположения STS. Полученные данные не позволяют установить порядок некоторых из них (номера в скобках). Интервалы между STS представлены одинаковыми; в действительности они неизвестны. |

| Рис. 20.19. Картирование с помощью упорядоченных STS (числа с 20 по 31 над горизонтальной линией). Точками указан STS-состав клонов f-j. STS упорядочены, что позволяет без труда идентифицировать перекрывающиеся клоны. |
ступающим концам рестрикционных фрагментов можно присоединять меченые линкеры.
Для выявления перекрывающихся участков необходимо проанализировать очень большое число космидных клонов, поэтому для поиска меченых рестрикционных фрагментов, общих для пары клонов, используют специальные компьютерные программы. ДНК-отпечаток каждого клона сканируют, информацию вводят в компьютер и проводят попарные сравнения. По результатам этих сравнений организуют из клонов контиги. Наличие перекрывающихся участков в клонах созданного контига подтверждается построением подробных рестрикционных карт вставок. Пробелы между контигами заполняют, выбирая зонды из ближайших концов соседних
Молекулярная генетика человека 465
|
| Рис. 20.20. Концевое мечение двух цепочечных ДНК с помощью ДНК-полимеразы Т4. 3'-экзонуклеазная активность ДΗК-полимеразы катализирует отщепление 3'-концевых нуклеотидов фрагментов ДНК с тупыми концами (А), с выступающими 3'- концам и (Б) или с выступающими 5'-концам и (В). Отщепление происходит до тех пор, пока на противоположной цепи не экспонируется основание, комплементарное меченому дезоксирибонуклеотиду, введенному в реакционную смесь (dGTP*); затем «включается» полимеразная активность ДНК-полимеразы Е4, и к 3'-концу присоединяется свободным меченый дезоксирибонуклеотид. Метка включается в оба конца фрагментов ДНК (на рисунке это не показано). Для мечения можно использовать любой дезоксирибонуклеотид. |
контигов и проводя скрининг библиотеки, содержащей крупные вставки, для поиска недостающих участков ДНК.
Транскрипционное картирование
Клоны кДНК-библиотеки представляют собой ДНК-копии тех транскриптов экспрессирующихся генов, которые присутствовали в конкретной ткани в момент экстракции из нее мРНК. «Привязка» индивидуальных клонов кДНК к хромосомным районам создает предпосылки к выявлению возможных кандидатов на роль генов тех или иных заболеваний. Если анализ генетического сцепления показывает, что ген данного заболевания находится в той же области хромосомы, что и кДНК-последовательностъ(ти), то можно проверить, не происходят ли данные клоны кДНК из гена этого заболевания.
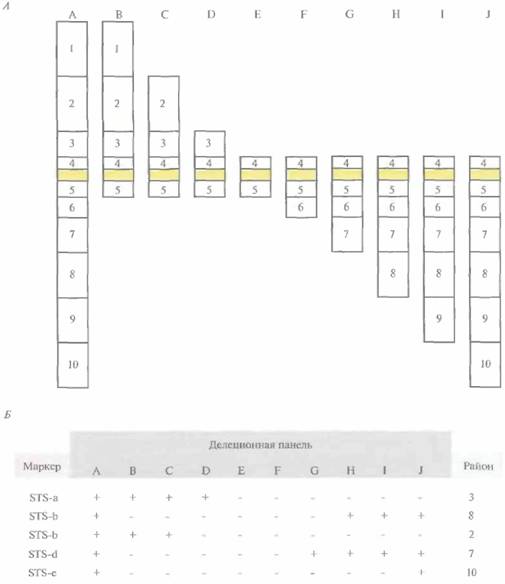
Привязку кДНК-клонов и других типов нуклеотидных экспрессируемых последовательностей к специфическим хромосомным районам называют транскрипционным картированием. Для построения транскрипционных карт используют различные методы. В одном из них частично секвенируют отдельные кДНК-клоны и на основе транслированной части каждой кДНК-вставки получают STS. Данный тип STS называют экспрессируемым STS (eSTS). Для определения хромосомной локализации eSTS используют линии соматических гибридных клеток, которые содержат единственную хромосому человека (монохромосомные гибриды) или фрагменты конкретной хромосомы человека (делеционную панель). Для этого ДНК каждого из монохромосомных гибридов амплифицируют методом ПЦР с использованием eSTS-праймеров и идентифицируют ту хромосому, которая содержит данный eSTS. Затем методом ПЦР-амплификации ДНК клеточных линий делеционной панели идентифицируют район хромосомы, в котором находится данный eSTS (рис, 20.21). Кроме того, внутригенные STS можно нанести на существующие РГ-карты. К 1996 г. на всех аутосомах и Х-хромосоме было картировано около 20 000 внутригенных STS человека.
Помимо экспериментов по картированию кДНК-клонов в хромосомных районах, в Институте исследования генома в Роквилле, Мэриленд (The Institute for Genome Research) и других
466 ГЛАВА 20
|
| Рис. 20.21. Привязка маркера к специфическому хромосомному району с использованием делеционной панели гибридных клеток, А. Схематическое представление районов хромосомы, присутствующих в монохромосомном клеточном гибриде (А) и в клеточных линиях В—J делеционной панели гибридных клеток. Районы (с 1 по 10) определяются границами дел еци и в хромосомах делеционной панели. Закрашенный прямоугольник - центромера каждой хромосомы. Б. Результаты ΠЦP-амплификации ДНК гибридных клеточных линий (A— J) с использованием STS-маркеров (с STS-a по STS-e). Наличие или отсутствие ПЦР-продукта указано знаком плюс или минус соответственно. Данные о наличии или отсутствии ПЦР-продуктов клеточных линий делеционной панели с STS-маркером используются для определения хромосомного района, в котором находится STS. Например, STS-d отнесен к району 7, поскольку соответствующий ПЦР-продукт образуется при амплификации каждой клеточной линии делеционной панели, в которой присутствует район 7. |
Молекулярная генетика человека 467
лабораториях приступили к реализации проекта по частичному секвенированию клонов кДНК-библиотек всех органов и тканей человека. Одной из задач этой программы является создание каталога коротких последовательностей (150—300 нуклеотидов) для каждого экспрессируемого гена человека. Такие короткие кодирующие последовательности называют маркерными экспрессируемыми последовательностями (EST, от англ, expressed sequence tags). С их помощью можно изучать размеры, разнообразие и транскрипционную активность экспрессирующихся генов человека. Более того, на основе EST можно создавать STS и использовать их для картирования и отбора геномных клонов, содержащих данный ген.
Частичное секвенирование кДНК-клонов и обработка полученных данных полностью автоматизированы. Каждую новую EST сравнивают с теми, которые уже были секвенированы, и если последовательность действительно является новой, ее вносят в базу данных по EST. Для поиска тмологии EST с известными генами или семействами генов и для определения категории, к которой относится функция представляемого ей гена, проводят дополнительные сравнения. К 1995 г. было идентифицировано примерно 300 000 EST из 300 кДНК-библиотек 37 органов и тканей. Примерно 90 000 EST представляют собой различающиеся экспрессирующиеся последовательности человека, из них примерно 10 000 соответствуют генам, роль которых в клетке известна, а остальные 80 000 — еще неоткрытым генам.
Клонирование генов заболеваний человека
Как правило, ген конкретного заболевания человека нельзя клонировать, руководствуясь каким-то заранее составленным набором экспериментальных протоколов. Выбор имеющихся в распоряжении исследователя методов и средств зависит от конкретных условий. Начало поиска гена заболевания определяется имеющейся информацией о продукте данного гена. В одних случаях генный продукт бывает хорошо известен, в других можно лишь догадываться, что он собой представляет. Наконец, для многих наследственных заболеваний природа генного продукта вообще неизвестна. Для каждого из этих случаев разработана своя стратегия. В целом для поиска гена заболевания существует четыре подхода: функциональное, кандидатное, позиционное и позиционно-кандидатное картирование. Независимо от применяемого подхода утверждать, что данный ген ассоциирован с интересующим исследователя заболеванием, можно лишь после того, как у больных обнаружены нуклеотидные изменения в гене, не встречающиеся в том же гене у здоровых индивидов.
Выявление мутаций в генах человека
Для выявления мутаций разработан целый ряд простых и недорогих подходов, таких как анализ конформационного полиморфизма одноцепо-чечной ДНК (SSCP, single-strand conformational polymorphism), градиентный гель-электрофорез в денатурируют их условиях (DGGE, denaturing gradient gel electrophoresis), гетеродуплексный анализ (НА, heteroduplex analysis), химическое расщепление некомплементарных сайтов (CMC, chemical mismatch cleavage), тест на укороченный белок (РТТ, protein truncation test).
Наиболее широко среди перечисленных подходов применяется SSCP. Суть метода состоит в следующем. Как можно большее (по возможности все) число экзонов исследуемого гена по отдельности амплифицируют методом ПЦР, используя в качестве матрицы ДНК больных и здоровых индивидов. Каждая пара праймеров выбирается из последовательностей, фланкирующих экзон, или из его концевых участков. Кроме того, используя данные секвенирования. выбирают праймеры для амплификации 5'-области, предшествующей первому экзону гена, 3'-области, следующей за последним экзоном, и участков, содержащих сайты сплайсинга.
ПЦР-продукты каждой реакции денатурируют, быстро охлаждают и разделяют с помощью электрофореза. Благодаря внутри цепочечному спариванию комплементарных оснований и образованию других связей денатурированная од-ноцепочечная молекула ДНК принимает определенную трехмерную конформацию, зависящую от ее нуклеотидной последовательности. Вследствие комплементарности две цепи одной молекулы ДНК имеют разную нуклеотидную после-
468 ГЛАВА 20
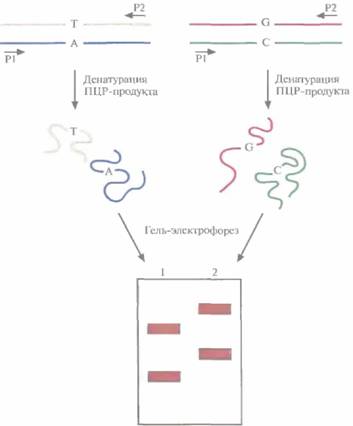
| Рис. 20.22. Анализ конформационного полиморфизма одноцепочечной ДНК (SSCP). Препараты ДНК, различающихся одной парой нуклеотидов (А:Т<--> G:C), амплифицируют ПЦР-методом с использованием одинаковых праймеров (PI , Ρ2). ПЦР-продукты денатурируют и разделяют с помощью гель-электрофореза на двух дорожках (1,2). Расстояние, на которое перемешается одноцепочечная молекула ДНК, зависит от ее конформации, а последняя, в свою очередь, — от нуклеотидной последовательности. Даже если ДНК различаются лишь одним нуклеотидным сайтом, одиночные цепи могут иметь разную конформацию, а следовательно, ПЦР-продукты образуют в геле не две, а четыре полосы. |
довательность, а поэтому принимают разную трехмерную конформацию и мигрируют при гель-электрофорезе с разной скоростью, В результате после разделения в геле наблюдаются две полосы, отвечающие разным комплементарным цепям. Если две молекулы ДНК, представляющие один и тот же участок гена, но полученные из разных источников, различаются одной парой нуклеотидов, то с большой вероятностью конформации одиночных цепей таких молекул ДНК будут различаться. Другими словами, каждая из четырех цепей будет перемещаться при гель-электрофорезе со своей скоростью (рис. 20,22). С помощью метода SSCP можно лишь локализовать нуклеотидные изменения в определенном экзоне или специфической области гена, но не определить природу мутации; такую информацию может дать лишь секвенирование. Метод SSCP имеет свои ограничения: он выявляет около 90% однонуклеотидных изменений в ПЦР-продуктах длиной не более 200 п. н.
Функциональное картирование
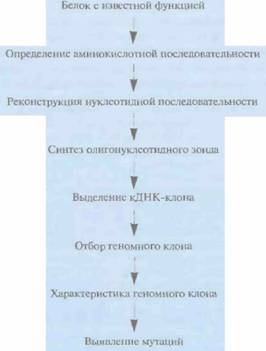
Функциональное картирование гена начинается с определения аминокислотной последовательности белка с известной функцией, что позволяет реконструировать нуклеотидную последовательность кодирующей области соответствующего гена (гена-мишени). Основываясь на этих данных, синтезируют олигонуклеотидные зонды и проводят скрининг кДНК-библиотеки, полученной для ткани, в которой данный белок присутствует в большом количестве. Если можно получить очищенную мРНК, с которой транслируется данный белок, то на ней как на матрице можно синтезировать полноразмерную кДНК и клонировать ее. Правильность выбора или синтеза кДНК-клона проверяют секвенированием.
Хромосомную локализацию гена-мишени определяют методом гибридизации in situ с кДНК-клоном или выбранным с его помощью геномным клоном. Для более точной локализации
Молекулярная генетика человека 469
гена-мишени можно также провести скрининг панели монохромосомных клеточных гибридов, а затем и соответствующей делеционной панели при помощи кДНК-клона или отобранного геномного клона.
Затем для определения клонов, гибридизующихся с данным кДНК-клоном, проводят скрининг космцдного контига, охватывающего хромосомный район, в котором локализован ген-мишень. Отобранные геномные клоны секвенируют и, используя данные о нуклеотидной последовательности кДНК, идентифицируют экзоны, интроны и 5'-, 3'-фланкирующие последовательности гена. В отсутствие космидного контига, охватывающего район нужной хромосомы, который содержит ген-мишень, выделяют клон с крупной вставкой, содержащей данный район, при помощи кДНК- или геномного зонда. Из клона с крупной вставкой получают субклоны с небольшими вставками, и проводят их скрининг при помощи кДНК-зонда. Позитивные клоны секвенируют и характеризуют ген-мишень (рис. 20.23).
| 
|
| Рис. 20.23. Функциональное картирование. Идентификация гена для случая, когда известна аминокислотная последовательность его продукта. | Рис. 20.24. Кандидатное картирование. Идентификация гена, основанная на анализе симптомов обусловленного им заболевания и соображений, какой из уже охарактеризованных генов может претендовать на роль искомого гена. |
Кандидатное картирование
Хотя этот подход не очень эффективен при картировании генов человека, в ряде случаев он может оказаться весьма полезным. Суть метола состоит в следующем. Анализируют симптомы генетического заболевания и на их основе пытаются понять, какого типа белок может быть с ним ассоциирован. Затем просматривают нуклеотидные последовательности всех клонированных на настоящий момент генов и выбирают ген(ы)-кандидат(ы). Основываясь на нуклеотидной последовательности гена-кандидата, вырабатывают стратегию поиска мутаций и с ее помощью пытаются установить, является ли ген-кандидат искомым геном (рис. 20.24). Принимая во внимание, что геном человека содержит очень большое число генов, а охарактеризованы лишь некоторые из них, не стоит удивляться, что правильный выбор гена случается не так уж часто. Но ценен и отрицательный результат, поскольку он позволяет исключить данный ген из числа ответственных за конкретное генетическое заболевание.
Позиционное картирование
Стратегия позиционного картирования применяется в тех случаях, когда ничего не известно о продукте гена, ответственного за наследствен-
470 ГЛАВА 20
ное заболевание, и нет никаких генов-кандидатов (рис. 20.25). В подобных случаях определяют хромосомную локализацию (позицию) гена заболевания и проводят его поиск, применяя различные инструменты и средства («охота за геном»). Благоприятной для позиционного картирования является ситуация, когда у нескольких больных встречается хромосомная перестройка типа транслокации или крупной делеции (> 10 т. п. н.). Предположив, что она затрагивает ген, ответственный за патологический фенотип, при анализе сцепления используют только один специфический район хромосомы вместо того, чтобы проводить сканирование всего генома при помощи большого числа полиморфных маркеров. После локализации гена в конкретном районе хромосомы определяют его положение более точно и идентифицируют ближайшие фланкирующие маркеры, используя мультилокусное картирование с дополнительными полиморфными зондами. Минимальное расстояние между картированными маркерными сайтами, при котором их можно разграничить, в лучшем случае составляет 1 сМ, что соответствует примерно 106 п. н. На таком участке может уместиться в среднем от 20 до 50 генов. Задача позиционного картирования состоит в том, чтобы определить, какой именно из них ответствен за данное заболевание.

|
| Рис. 20.25. Позиционное картирование. Идентификация гена, продукт которого неизвестен, с помощью хромосомного картирования и зондов, специфичных в отношении тесно сцепленных маркеров. |
Из контига, охватывающего район хромосомы, содержащий ген заболевания, выбирают геномные клоны, которые включают фланкирующие маркеры и заключенный между ними участок ДНК. Если такой контиг отсутствует, то с помощью зондов, специфичных в отношении тесно сцепленных маркерных сайтов, проводят скрининг библиотек геномных ДНК для выявления клонов, происходящих из того района, который содержит искомый ген. Между 1986 и 1990 гг., когда метод «охоты за генами» человека еще только разрабатывался, для идентификации нужных геномных клонов использовали метод «прыжков по хромосоме» (рис. 20.26) или метод «прогулки по хромосоме» (рис. 20.27). После создания геномных библиотек, содержащих крупные фрагменты ДНК человека, и контигов эти стратегии утратили свою актуальность.
Независимо от того, как именно получены нужные геномные клоны, важно знать, какие из

|
| Рис. 20.26. Создание библиотеки методом «прыжков по хромосоме». Проводят частичный гидролиз геномной ДНК рестриктазой, делающей небольшое число разрывов, и выделяют фрагменты длиной примерно 200 т. п. н. Сшивают их с геном supF (~7т. п.н.) и замыкают в кольцо. Буквами А и В, X и Y, S и Т обозначены сайты, исходно находящиеся друг от друга на расстоянии 200 т. п. н., но после циклизации фрагментов разделенные 7 т, п. н. Кольцевые молекулы, содержащие множество сайтов для EcoRI, обрабатывают этой рестриктазой, в результате чего среди прочих образуются фрагменты, содержащие ген supF и фланкирующие его последовательности (А и В; X и Y; S и Т). Из всех фрагментов отбирают лишь те, длина которых составляет примерно 20 т. п. н., и встраивают их в вектор на основе фага λ. Векторы, несущие ген supF, будут амплифииироваться в SupF~ -клетках-хозяевах. Идентифицируют клон, гибридизующийся с зондом, специфичным в отношении исходной последовательности (А, X, S), затем субклонируют его; при этом та его часть, которая не гибридизуется с зондом, содержит участок ДНК (В, Y, Т), находящийся на расстоянии 200 т, п. н. от исходной последовательности. |
Молекулярная генетика человека 471

|
472 ГЛАВА 20

| Рис. 20.27. «Прогулка по хромосоме». А. Зонд 1 гибридизуют с клонированным фрагментом ДНК длиной 40 т.п.н. После субклонирования и построения рестрикционной карты последовательность, дистальную по отношению к гибридизовавшейся, используют для создания зонда 2, Б, При помощи зонда 2 из библиотеки выбирают другой клон (отличный от клона 1) и используют последовательность, дистальную по отношению к гибридизовавшейся с ним, для создания зонда 3. Клоны 1 и 2 вместе составляют примерно 80 т.п.н. (за вычетом перекрывающегося участка — зонд 2 — между ними), В. Проводят манипуляции, аналогичные А и Б, используя зонд 3. Третий клон «прогулочной» библиотеки позволяет продвинуться по хромосоме еще на 40 т. п. н. Г. Три перекрывающихся фрагмента ДНК охватывают примерно 120 т. п, н, хромосомной ДНК. «Прогулку» по хромосоме можно совершать в двух направлениях, руководствуясь при этом рестрикционной картой. |
них или из субклонов содержат экзоны. Для этого можно использовать целый рад прямых и косвенных методов, таких как идентификация CpG-островков, межвидовой Саузерн-блоттинг, отбор гибридов, улавливание экзонов, секвениро-вание ДНК, компьютерный поиск.
Транскрибируемым участкам геномов позвоночных часто предшествуют кластеры нуклеотидов, богатые остатками С и G (CpG-островки). Группу CpG-островков можно идентифицировать по скоплению на рестрикционной карте сайтов для рестрицирующих эндонуклеаз EagI, BssII и SacII. Если как минимум два таких сайта отделены 5—10 т. п. н. друг от друга, значит, они находятся в пределах CpG-островка. Это не гарантирует, что именно здесь находится экзон, но указывает на наличие где-то поблизости транскрибируемого гена.
Молекулярная генетика человека 473
Геномные клоны или субклоны можно гибридиэовать по Саузерну с рестрицированной геномной ДНК различных позвоночных, например с ДНК мыши, крысы, кролика, обезьяны, коровы, цыпленка, рыбы (зооблот, межвидовой блоттинг, блоттинг «Ноев ковчег»). Положительная перекрестная гибридизация означает, что данный клон с большой вероятностью содержит кодирующие последовательности, поскольку многие экзоны в ходе эволюции не изменялись, в то время как повторяющиеся и некодирующие последовательности ДНК, в том числе и интроны, претерпели существенные изменения. Положительный зооблот означает, что клон содержит экзон(ы), однако не показывает, есть ли в нем ген искомого заболевания.
Отбор гибридов позволяет быстро и с высокой эффективностью идентифицировать геномный клон, содержащий экзон(ы), и одновременно изолировать соответствующую кДНК, Отбор можно проводить разными способами. Обычно ДНК геномного клона из той области хромосомы, которая содержит ген заболевания, фиксируют на твердой подложке, проводят пре-гибридизацию с повторяющимися последовательностями ДНК, а затем гибридизуют с линейными векторными молекулами со вставками из кДНК-библиотеки, происходящей из ткани, вероятнее всего экспрессирующей ген-мишень. Нсгибридизовавшисся векторные молекулы смывают с фильтра, а гибридизовавшиеся элюируют и амплифицируют методом ПЦР, используя праймеры из векторных последовательностей, фланкирующих кДНК-вставку (рис. 20.28). Если точно неизвестно, в какой ткани экспрессируется ген-мишень, то кДНК-библиотеки разных тканей объединяют и проводят гибридизацию с отдельными геномными клонами. ПЦР-продукт можно затем клонировать и тестировать, с тем чтобы проверить, содержит ли он кодирующую часть гена данного заболевания. Для этого можно секвенировать кДНК и провести компьютерное сравнение нуклеотидных последовательностей этой ДНК и известных генов. Если будет получена высокая степень гомологии, можно сделать определенные выводы о том, какого типа белок кодирует данная кДНК, и если этот белок таков, что его с высокой вероятностью можно считать продуктом гена-мишени, то данный(е) клон(ы) секвенируют и идентифицируют экзоны, интроны и 5'-, 3'-фланкирующие области. Альтернативный подход состоит в поиске мутаций с целью выявления нуклеотидных различий между ДНК
Дата добавления: 2015-04-16; просмотров: 100; Мы поможем в написании вашей работы!; Нарушение авторских прав |