
КАТЕГОРИИ:
АстрономияБиологияГеографияДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРиторикаСоциологияСпортСтроительствоТехнологияФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Составление уравнений окислительно-восстановительных реакций по методу электронного баланса
Окислительно–восстановительными называются реакции, в результате которых изменяется степень окисления одного или нескольких элементов, входящих в состав реагирующих веществ.
Отдача атомом электронов (сопровождается повышением степени окисления), называется окислением.
Присоединение атомом электронов (сопровождается понижением степени окисления), называется восстановлением.
Вещество, в состав которого входит окисляющийся элемент, называется восстановителем; вещество, содержащее восстанавливающийся элемент, называется окислителем.
Задачи
Используя метод электронного баланса, расставить коэффициенты в уравнениях. В необходимых случаях впишите недостающие молекулы воды. Укажите окислители и восстановители.
86. As2S3 + HNO3 → H3AsO4 + NO2 + H2SO4
87. Cu2S + HNO3 → Cu(NO3)2 + H2SO4 + NO2
88. FeS + HNO3 → Fe(NO3)3 + H2SO4 + NO2
89. Cr2Se3 + HNO3 +PbO2 → H2Cr2O7 + PbSeO4 + Pb(NO3)2
90. MoS2 + HNO3 +PbO2 → H2MoO4 + PbSO4 + Pb(NO3)2
91. Cu2S + HNO3 → Cu(NO3)2 + H2SO4 + NO
92. Fe(CrO2)2 + K2CO3 + O2 → Fe2O3 +K2CrO4 + CO2
93. C + S + KNO3 → N2 + CO2 +K2S
94. FeS2 + HNO3 → Fe(NO3)3 + H2SO4 + NO
95. As2S3 + HNO3 → H3AsO4 + NO + H2SO4
96. Cu2S + Fe2(SO4)3 → FeSO4 + CuSO4 + S
97. Cr2S3 + HNO3 +PbO2 → H2Cr2O7 + PbSO4 + Pb(NO3)2
98. MoS2 + O2 → SO2 +MoO3
99. Fe(CrO2)2 + C → CO + Fe + Cr
100. As2S3 + H2O2 + NH4OH → (NH4)3AsO4 + (NH4)2SO4 + H2O
101. CuFeS2 + HNO3 → Fe(NO3)3 +CuSO4 + H2SO4 + NO
102. FeS2 + O2 → Fe2O3 + SO2
103. As2S3 + HClO3 → H3AsO4 + H2SO4 + HCl
104. FeS + O2 → Fe2O3 + SO2
105. NaCrO2 + Br2 + NaOH → Na2CrO4 + NaBr + H2 + H2O
Закончить уравнения реакций, написав их в ионном и молекулярном виде:
106. KMnO4 + MnSO4 +H2O →
107. Sb3+ + Zn +H+ → SbH3 +
108. C2O  + J
+ J  → CO2 +
→ CO2 +
109. PCl3 + ClO 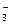 + H2O →
+ H2O →
110. HPO  + Hg2+ + H2O → Hg+ +
+ Hg2+ + H2O → Hg+ +
Дата добавления: 2015-04-16; просмотров: 87; Мы поможем в написании вашей работы!; Нарушение авторских прав |