
КАТЕГОРИИ:
АстрономияБиологияГеографияДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРиторикаСоциологияСпортСтроительствоТехнологияФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Законы физической химии в сталеплавильном производстве
В процессе плавки стали происходит взаимодействие различных фаз − металлической, шлаковой, газовой и футеровки. Они отличаются по агрегатному состоянию и химическому составу.


|
Рис. 1. Агрегатное состояние и основные компоненты взаимодействующих фаз
Таким образом, результатом такого взаимодействия являются различные обменные процессы, т.е. переход химических элементов из одной фазы в другую. Это объясняется тем, что в разных фазах могут быть разные химические (изобарные) потенциалы элементов. Изобарные потенциалы могут быть созданы искусственно, или складываться естественно.
Для получения заданного состава и качества стали, основным является взаимодействие металла со шлаковой и газовой фазами (т.е. взаимодействие жидкой и газовой фаз).
Сталеплавильный процесс преимущественно окислительный, т.е. идут реакции окисления кремния, марганца, фосфора, углерода, хрома, сопровождающиеся переходом их из металла в шлак. Степень завершенности процессов окисления зависят от температуры и состава шлака.
Т.к. взаимодействующие компоненты и продукты сталеплавильных реакций находятся в различных фазах, они называются гетерогенными, идущими в несколько стадий:
1. Массоперенос веществ в объеме фаз и на границу раздела;
2. Химическая реакция взаимодействия реагирующих веществ;
3. Отвод продуктов реакции в объем фаз.
Стадии 1 и 3 называют диффузионными (диффузия веществ). Стадия 2 − кинетическая. Скорость диффузионных стадий значительно меньше скорости кинетической стадии. Суммарная скорость реакции определяется самой медленной стадией. Т.о. в сталеплавильном производстве скорость процесса определяется законом диффузионных стадий. Для их ускорения применяют перемешивание металла.
Изучение процессов происходит по следующим направлениям:
1. Определение возможного направления протекания процесса;
2. Установление предела протекания химической реакции (позволяет установить степень удаления примеси из металла);
3. Определение возможной скорости процесса и влияющих на нее факторов (важно для установления производительности агрегата).
 Первая и вторая задачи решаются с помощью законов термодинамики. Для сталеплавильных процессов направление протекания реакции определяется по знаку изменения потенциала Гиббса (ΔGoт).
Первая и вторая задачи решаются с помощью законов термодинамики. Для сталеплавильных процессов направление протекания реакции определяется по знаку изменения потенциала Гиббса (ΔGoт).
Если ΔG < 0, то реакция идет слева направо; ΔG > 0 − в обратном направлении и ΔG = 0 − это состояние термодинамического равновесия.
Например:
| Реакция | ΔGoт, кДж/моль | ΔGo1600, кДж/моль |
| [Mn] + [O] = (MnO) | − 244,69 + 0,109 Т | − 40,5 |
| ½ [Si] + [O] = ½(SiO2) | − 271,17 + 0,102 T | − 80,0 |
| 2/3[Al] + [O] = 1/3(Al2O3)т | − 367,1 + 0,131 Т | − 121,7 |
| 2/5[P] + (FeO) = 1/5(P2O5) + [Fe] | − 71,52 + 0,033 T | − 9,7 |
| 2/5[P]+[O]+3/5(CaO)=1/5(Ca3P2O8) | − 134,08 + 0,038 T | − 62,9 |
| ½[S] + [O] = ½{SO2} | 2,8+0,027 T | 53,37 |
| [C] + [O] = {CO} | − 35,62 − 0,031 T | − 93,7 |
| [C] + (FeO) = [Fe] + {CO} | 85,43 − 0,084 T | − 71,9 |
| [C] + ½{O2} = {CO} | − 152,57 − 0,034 T | − 216,6 |
Выводы:
1. В сталеплавильной ванне возможно протекание всех реакций, кроме окисления серы. Сера может окисляться только в вакууме.
2. Наиболее полно протекает реакция окисления алюминия.
3. В кислом процессе, когда в шлаке не могут образовываться фосфаты, P2O5 остается практически в свободном состоянии. Окисление фосфора более глубокое, если P2O5 переходит в основной шлак, но дефосфорация металла не существенна.
4. Углерод окисляется интенсивно, особенно газообразным кислородом.
Изменение потенциала Гиббса связано с константой равновесия, являющейся критерием полноты протекания реакций:
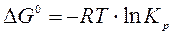 .
.
Константа равновесия зависит от температуры:
 ,
,
где ΔQ − тепловой эффект реакции;
R − универсальная газовая постоянная.
Если реакция экзотермическая (ΔQ >0, т.е. с выделением тепла), то температурная функция убывает  , т.е. с ростом температуры Т константа равновесия убывает. Для эндотермических реакций (ΔQ <0, т.е. с поглощением тепла)
, т.е. с ростом температуры Т константа равновесия убывает. Для эндотермических реакций (ΔQ <0, т.е. с поглощением тепла)  , т.е. с ростом температуры возрастает и константа.
, т.е. с ростом температуры возрастает и константа.
Если в реакции участвуют чистые вещества, то константа равновесия определяется (через концентрацию компонентов):

 ,
,
где Сi − концентрация i-го компонента,
 ,
,
где Mi − масса i-го компонента.
Если в реакции компоненты газовой фазы (через парциальное давление):

 ,
,
где Pi − парциальное давление i-го компонента,
 ,
,
где P − общее давление в системе; Ni − мольная доля i-го компонента,
 ,
,
где n − число молей.
Если продукты реакции − компоненты растворов (через их активность):

 ,
,
где αi − активность i-го компонента,
 , − основное выражение для сталеплавильных процессов.
, − основное выражение для сталеплавильных процессов.
где γi − коэффициент активности i-го компонента (характеризует взаимодействие данного компонента с другими компонентами раствора).
γ = 1, компоненты не взаимодействуют − идеальный раствор,  ,
,
γ<1, компоненты взаимодействуют − реальный раствор,  .
.
 Пример использования физхимии в решении практической задачи: реакция окисления марганца, растворенного в жидком железе.
Пример использования физхимии в решении практической задачи: реакция окисления марганца, растворенного в жидком железе.
[Mn] + (Fe) = (MnO) + Feж, ΔGo = - 120000 + 60Т.
Из соотношения для ΔGo следует, что:
þ при окислении марганца выделяется тепло;
þ при повышении Т знак «минус» может поменяться на знак «плюс».
$s Какие факторы могут повлиять на концентрацию марганца?
Из выражения для константы равновесия
 , следует что
, следует что  , т.е. чем меньше α(FeO) , тем больше [Mn].
, т.е. чем меньше α(FeO) , тем больше [Mn].
$sКак уменьшитьα(FeO)?
þ можно раскислить ванну, т.е. уменьшить окисленность и металла , и шлака.
þ создать благоприятные условия для протекания реакции [C] + (FeO) = COг + Feж , тогда окисленность шлака α(FeO) уменьшится и произойдет восстановление марганца из шлака.
Дата добавления: 2014-12-03; просмотров: 88; Мы поможем в написании вашей работы!; Нарушение авторских прав |