
КАТЕГОРИИ:
АстрономияБиологияГеографияДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРиторикаСоциологияСпортСтроительствоТехнологияФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Порядок выполнения работы. 1. После разрешения преподавателя тумблером в модуле «СЕТЬ» подайте на установку напряжение 220 В
1. После разрешения преподавателя тумблером в модуле «СЕТЬ» подайте на установку напряжение 220 В. При этом на панели модуля загорится сигнальная лампа (светодиод).
2. Включите подачу воздуха в колбу, установив тумблер в модуле «ВОЗДУХ» в положение «ВКЛ.». При этом загорится светодиод, и начнет работать микрокомпрессор. Внимательно следите за подъемом уровня воды в левой трубке манометра. Этот уровень во всех случаях не должен превышать 200 дел. по шкале манометра. После достижения рабочего давления в 3,0 – 3,5 кПа выключите тумблер в модуле «ВОЗДУХ».
3. Через 10 - 15 с произведите отсчет давления pМ1 по манометру (по разности уровней воды в его трубках). Занесите это значение давления pМ1 в таблицу.
4. Немного поверните ручку пневмоклапана «АТМОСФЕРА» по часовой стрелке, и, как только уровни воды в трубках манометра установятся на нуле, верните ручку пневмоклапана в исходное положение.
5. Следите за подъемом давления в колбе, и после того как положения уровня воды в трубках перестанут изменяться, запишите в таблицу величину давления pМ2.
6. Все действия и измерения повторите еще 4 раза. Рассчитайте величины γ1,…, γ5 по формуле (3) и найдите среднее значение <γ>.
7. Рассчитайте абсолютную погрешность Δγ, приняв ее равной стандартной погрешности:

и занесите значение Δγ в таблицу.
Найдите относительную погрешность измерений 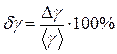 и занесите значение δγ в таблицу.
и занесите значение δγ в таблицу.
Таблица
| № опыта | pМ1, кПа | pМ2, кПа | γ | <γ> | Δγ | δγ, % |
8. Запишите окончательный результат работы в виде: γ = <γ>±Δγ с относительной погрешностью δγ = ….%.
Контрольные вопросы
1. Какой газ принято считать идеальным?
2. Какие изопроцессы Вы знаете? Запишите уравнения этих процессов.
3. Как связаны величины молярных теплоёмкостей CV и Cp между собой? Какая из этих величин больше и почему?
4. Как связаны величины молярных теплоёмкостей CV и Cp идеального газа с числом степеней свободы его молекул?
5. На основании полученного экспериментально в данной лабораторной работе значения γ для воздуха сделайте заключение о строении молекул основных газов в его составе.
6. Для тестов, приведенных далее, выберите правильный вариант ответа:
Задание № 1
Средняя кинетическая энергия молекул газа при температуре Т зависит от их структуры, что связано с возможностью различных видов движения атомов в молекуле. При условии, что имеют место только поступательное и вращательное движения, средняя кинетическая энергия молекул азота (N2) равна ...
ВАРИАНТЫ ОТВЕТОВ:
1) kT/2 ; 2) 3kT/2; 3) 5kT/2; 4) 3kT; 5) 7kT/2
Задание № 2
Состояние идеального газа определяется значениями параметров: T0, p0, V0,
где Т – термодинамическая температура, р – давление, V – объем газа. Определенное количество газа перевели из состояния (р0, V0 ) в состояние
(2р0, Vo/3). При этом его внутренняя энергия...
ВАРИАНТЫ ОТВЕТОВ:
1) не изменилась; 2) уменьшилась;3) увеличилась.
Задание № 3
Если DU – изменение внутренней энергии идеального газа, А – работа газа,
Q – количество теплоты, сообщаемое газу, то для адиабатного расширения газа справедливы соотношения...
ВАРИАНТЫ ОТВЕТОВ:
1) Q>0; A>0; DU=0; 2) Q<0; A<0; DU=0;
3) Q=0; A<0; DU>0; 4) Q=0; A>0; DU<0.
Задание № 4
Если DU – изменение внутренней энергии идеального газа, А – работа газа,
Q – количество теплоты, сообщаемое газу, то для изотермического сжатия газа справедливы соотношения...
ВАРИАНТЫ ОТВЕТОВ:
1) Q=0; A<0; DU>0; 2) Q<0; A>0; DU=0;
3) Q>0; A<0; DU<0; 4) Q<0; A<0; DU=0.
Задание № 5
Если DU – изменение внутренней энергии идеального газа, А – работа газа,
Q – количество теплоты, сообщаемое газу, то для изобарного расширения газа справедливы соотношения...
ВАРИАНТЫ ОТВЕТОВ:
1) Q=0; A>0; DU<0; 2) Q>0; A>0; DU>0;
3) Q<0; A<0; DU>0; 4) Q>0; A>0; DU=0.
Задание № 6
Если DU – изменение внутренней энергии идеального газа, А – работа газа,
Q – количество теплоты, сообщаемое газу, то для изохорного нагревания газа справедливы соотношения...
ВАРИАНТЫ ОТВЕТОВ:
1) Q=0; A<0; DU>0; 2) Q<0; A=0; DU>0;
3) Q>0; A=0; DU>0; 4) Q>0; A>0; DU>0.
Задание № 7
Давление идеального газа в сосуде уменьшилось в 4 раза, а его абсолютная температура понизилась вдвое. Сколько газа (в %) выпустили из сосуда?
ВАРИАНТЫ ОТВЕТОВ:
1) 20 %; 2) 40 %; 3) 50 %; 4) 80 %.
Задание № 8
Если в открытом сосуде увеличить абсолютную температуру идеального газа вдвое, то как изменится в результате этого концентрация молекул газа в сосуде?
ВАРИАНТЫ ОТВЕТОВ:
1) уменьшится вдвое; 2) увеличится вдвое;
3) уменьшится в 4 раза; 4) не изменится.
Задание № 9
Какая часть переданного одноатомному газу теплоты Q при изобарном нагревании идет на увеличение его внутренней энергии?
ВАРИАНТЫ ОТВЕТОВ:
1) 0,2 Q; 2) 0,4 Q; 3) 0,5 Q; 4) 0,6 Q.
Задание № 10
При адиабатическом сжатии 4 г гелия (М = 4·10-3 кг/моль) совершена работа 600 Дж. Чему равно изменение температуры гелия в этом процессе?
ВАРИАНТЫ ОТВЕТОВ:
1) –72 К; 2) –24 К; 3) 0 К; 4) 48 К.
Задание № 11
 Какую работу совершил одноатомный газ в процессе, изображённом на pV - диаграмме?
Какую работу совершил одноатомный газ в процессе, изображённом на pV - диаграмме?
ВАРИАНТЫ ОТВЕТОВ:
1) 1,5 кДж;
2) 2,5 кДж;
3) 3 кДж;
4) 4 кДж
Задание № 12
На графике показана зависимость температуры от давления идеального одноатомного газа. Внутренняя энергия газа увеличилась на 20 кДж. Количество теплоты, полученное газом, равно…

ВАРИАНТЫ ОТВЕТОВ:
1) 0 кДж;
2) 10 кДж;
3) 20 кДж;
4) 40 кДж;
Дата добавления: 2014-10-31; просмотров: 238; Мы поможем в написании вашей работы!; Нарушение авторских прав |