
КАТЕГОРИИ:
АстрономияБиологияГеографияДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРиторикаСоциологияСпортСтроительствоТехнологияФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
В эту формулу значения
величин подставляются в единицах СИ,  ,
,  , -
, -
масса растворителя в объёме V. Для воды при 298 К диэлектрическая постоянная  и значение
и значение 
Подробное описание модели Дебая-Хюккеля приведено в книге «Физическая химия», под ред. академика Б. П. Никольского. Ленинград, «Химия», 1987 г., стр. 431 -440.
Если перейти к среднему ионному коэффициенту активности, то выражение для него будет иметь вид

|
(7.24)

где z+ и z- - модули зарядов ионов. Формула (7.24) справедлива для растворов с ионной силой около 0.01 М и представляет собой предельный закон для малых концентраций, как и закон идеальных газов для низких давлений. Экспериментальная и теоретическая зависимости среднеионного коэффициента активности изображены на рис.7.1.
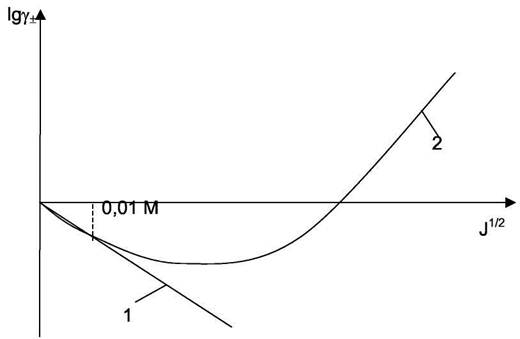
Рис 7.1. Экспериментальная и теоретическая зависимости логарифма среднеионного коэффициента активности от ионной силы раствора:
Дата добавления: 2014-12-23; просмотров: 90; Мы поможем в написании вашей работы!; Нарушение авторских прав |