
КАТЕГОРИИ:
АстрономияБиологияГеографияДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРиторикаСоциологияСпортСтроительствоТехнологияФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Атомных (ионных) радиусов
Известны и практикуются разные способы определения размеров атомов (орбитальные, ковалентные, металлические, ван-дер-ваальсовые радиусы) и ионов (орбитальные, кристаллохимические). В данном пособии будут рассмотрены основные закономерности изменения только орбитальных радиусов.[9] Из сказанного на стр.23, следует, что определяемые расчетным путем орбитальные радиусы характеризуют размер изолированных (газообразных) атомов. Фактически речь, в данном случае, идет о размере электронного облака. Как и облако водяных паров, электронное облако имеет очертание, но не конкретные границы. В то же время – это важнейшая атомная характеристика, с которой связаны многие другие свойства изолированных атомов.
Из качественных соображений понятно, что размер электронного облака должен зависеть от заряда ядра атома и числа электронных оболочек (главного квантового числа валентных электронов). Строгий вид этой зависимости для одноэлектронных частиц отражен в формуле (1.27).[10] Из этих соображений орбитальные радиусы в периодах должны уменьшаться, т.к. при одинаковом главном квантовом числе валентных электронов (при одинаковом электронном строении внутренних оболочек, одинаковом эффекте экранирования) растет заряд ядра, усиливается связь электронов с ядром. Все электронные облака (и внутренние, и валентные) становятся все более компактными и плотными. Например, для атомов Li и Ne, первого и последнего элементов второго периода это схематично может быть показано следующим образом:

Li Ne
z = 3 z = 10
1s22s1 1s22s22p6
| Рис. 1.11 – Схематичное изображение электронных облаков и графиков радиального распределения вероятности пребывания электронов в атомах лития и неона. |
Переход от Ne к Na также сопровождается ростом заряда ядра на единицу и, поэтому размер 1s-, 2s- и 2р-орбиталей несколько уменьшатся. Но, поскольку атом натрия возглавляет III-ий период периодической системы, его размер будет определяться 3s-электронным облаком, а оно из-за роста главного квантового числа будет гораздо крупней орбиталей второго энергетического уровня. Поэтому орбитальный радиус атома резко увеличивается. Далее в пределах третьего периода размеры атомов опять же в целом уменьшаются, а при переходе от Ar к K вновь наблюдается резкий скачек орбитального радиуса[11]:
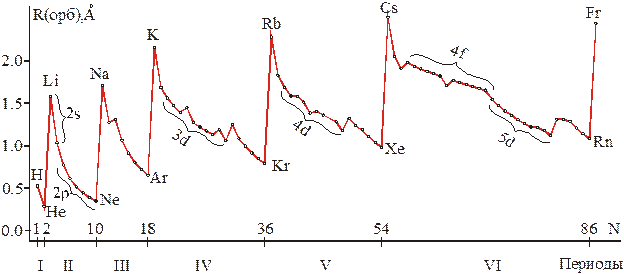
| Рис. 1.12 – Схема изменения орбитальных радиусов атомов в зависимости от порядкового номера элементов и их расположения в периодической системе. |
На приведенной схеме видна не только периодичность изменения размеров атомов, но и отмечавшаяся ранее связь структуры периодической системы с электронным строением атомов. Видно, что все периоды за исключением I-го начинаются с ns-, а завершаются np-элементами. По мере заселения соответствующих орбиталей уменьшается радиус (происходит s- и р-сжатия атомов). Причем s-сжатие имеет место во всех периодах, а 2р-сжатие впервые сказывается на размерах атомов конца второго периода. Поэтому Li гораздо крупнее, чем атом водорода, а атом Ne, лишь немногим больше атома Не[12]. Аналогично 3d- и 4f-сжатия дополнительно занижают размеры атомов, замыкающих IV–й и VI–й периоды, соответственно –сравните, например, радиусы Na–K и Ar–Kr или Rb–Cs и Xe–Rn (табл. 1.5).
 Особенно сильно эффекты сжатия сказываются в тех случаях, когда орбитальный радиус определяется размером внешнего s–электронного облака. Это объясняется сильным эффектом проникновения внешних s–электронов под слабо экранирующие 2р-, 3d- и 4f-орбитали[13], в результате чего заметно усиливается взаимодействие "проникающих" электронов с ядром атома.
Особенно сильно эффекты сжатия сказываются в тех случаях, когда орбитальный радиус определяется размером внешнего s–электронного облака. Это объясняется сильным эффектом проникновения внешних s–электронов под слабо экранирующие 2р-, 3d- и 4f-орбитали[13], в результате чего заметно усиливается взаимодействие "проникающих" электронов с ядром атома.
Наиболее наглядно влияние эффектов сжатия атомов проявляется при обсуждении орбитальных радиусов элементов одной подгруппы. В подгруппах одновременно увеличивается и заряд ядра, что способствует уменьшению размера атомных орбиталей, и главное квантовое число, число энергетических уровней (с ростом n увеличивается протяженность электронных облаков). Поэтому изменение орбитальных радиусов в подгруппах на основе качественных соображений менее предсказуемо, чем для элементов одного периода. Однако, как видно из рис.1.13, главное квантовое число оказывает более сильное влияние на радиусы атомов, и они в целом увеличиваются. В то же время, когда в предвнешнем энергетическом уровне атома появляются заполненные кайносимметричные орбитали, сказывается эффект сжатия валентных электронных облаков и рост радиуса замедляется.Более того, 4f-сжатие внешних s–орбиталей оказывается настолько сильным, что в этих случаях орбитальные радиусы даже уменьшаются (наблюдается, так называемая лантаноидная контракция).
Рассмотрим, в качестве примера, электронное строение и закономерности изменения орбитальных радиусов в некоторых подгруппах s-, p- и d-элементов:
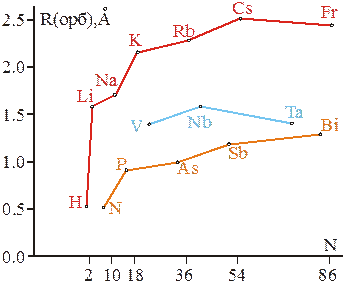
| Рис.1.13 – Влияние эффектов сжатия на закономерности изменения орбитальных радиусов в некоторых подгруппах s–, p– и d–элементов периодической системы. |
В качестве итогового обобщения можно отметить следующее:
· 2р-сжатие представляет лишь теоретический интерес, т.к. сказывается на изменении размеров небольшого числа атомов: Не–Ne, Li–Na.
· 3d– и 4f–сжатия – гораздо более распространенные явления, заметно сказывающиеся на другие атомные свойства (в частности, на энергии ионизации), а также структуры и свойства однотипных соединений элементов подгрупп.
· Впервые 3d–сжатие проявляется в размерах атомов Al–Ga (Ga–первый после 3d–элементов). В последующих парах р–элементов (Si–Ge, N–P,…, Ar–Kr) эффект 3d–сжатия также наблюдается, но его последствия монотонно ослабевают. Это можно объяснить постепенной стабилизацией предвнешнего 3d–подуровня так, что внешние 4р–электроны все хуже под них проникают, эффект экранирования заряда ядра для 4р–электронов растет:

| Рис. 1.14 – Уменьшение последствий эффектов 2р–, 3d– и 4f–сжатия атомов по мере роста заряда ядра. |
В подгруппах s–элементов 3d–сжатие вновь становится более заметным ввиду большей проникающей способности s–электронов (K–Rb, Ca–Sr, рис.3.8), но на изменении радиусов Ca–Sr он также сказывается слабей: ΔR(орб) в парах K–Rb и Ca–Sr составляют 0.125 Å и 0.146 Å, соответственно. В дальнейшем (Sc–Y, Ti–Zr, …), т.е. в подгруппах d–элементов закономерности в изменении эффекта 3d–сжатия выражены слабо. Это связано с несколькими причинами: близость энергий ns– и (n-1)d–орбиталей, изменение радиусов за счет электронных проскоков.
· 4f–сжатие впервые сказывается на радиусах атомов Zr–Hf. В последующих подгруппах из общих соображений (постепенная стабилизация 4f–орбиталей, усиливающиеся проблемы с проникновением 6s–электронов) следует ожидать уменьшения влияния 4f–сжатия на размеры атомов. Но в подгруппах d–элементов по вышеназванным причинам эта закономерность не прослеживается. В то же время в рядах р– и s–элементов последствия лантаноидного сжатия закономерно ослабевают:
Таблица 1.6
Зависимость эффекта 4f–сжатия от заряда ядра и типа
проникающих валентных электронов
| 5р–элементы | In | Sn | Sb | Te | J | Xe | 6s–элементы | Cs | Ba |
| R(орб), Å | 1.328 | 1.240 | 1.193 | 1.111 | 1.044 | 0.986 | 2.518 | 2.060 | |
| 6р–элементы | Tl | Pb | Bi | Po | At | Rn | 7s–элементы | Fr | Ra |
| R(орб), Å | 1.319 | 1.315 | 1.295 | 1.212 | 1.146 | 1.090 | 2.447 | 2.042 | |
| ΔR(орб), Å | -0.009 | 0.075 | 0.102 | 0.101 | 0.102 | 0.104 | -0.071 | -0.018 |
Орбитальные радиусы ионов вполне прогнозируемым образом отличаются от атомных. Например, добавление дополнительного электрона к атому усиливает межэлектронное отталкивание, поэтому при одинаковом заряде ядра и эффекте его экранирования (одинаковая электронная структура внутренних, в том числе и предвнешнего энергетического уровня) размер валентных электронных облаков анионов несколько увеличивается. В то же время при потере валентных электронов орбитальный радиус уменьшается. особенно сильно меняется размер электронного облака катиона в тех случаях, когда при ионизации устраняется какой-либо электронный подуровень или, тем более, полностью теряются все валентные электроны. Таким образом, обычно

Таблица 1.7
Зависимость орбитальных радиусов
от заряда атома и типа проникающего электрона
(влияние эффектов сжатия)

В приведенной таблице следует обратить внимание на несколько важных фактов:
· Орбитальные радиусы атома и аниона хлора очень близки, в то время как размеры атома и катиона калия отличаются очень сильно. Резкое уменьшение радиуса катиона, в первую очередь, объясняется удалением электрона, создававшего самое крупное электронное облако. Кроме того, при удалении электрона, пусть и незначительно, но уменьшился эффект экранирования. В свою очередь, радиус аниона слегка увеличивается именно за счет усиления межэлектронного отталкивания, увеличения эффекта экранирования заряда ядра.
· Орбитальные радиусы изоэлектронных ионов Cl– и К+ не совпадают из-за большего заряда ядра атома калия.
· Более сложной и менее очевидной является интерпретация того, как меняются орбитальные радиусы при последовательной ионизации р– и d–элементов:
–разница в энергиях между ns– и nр–орбиталями достаточно заметна, поэтому потеря валентных, практически не проникающих р–электронов мало влияет на энергию и размер ns–электронного облака. Гораздо сильней меняется ионный радиус при удалении ns–электронов.
– разница в энергиях между ns– и (n-1)d–орбиталями гораздо меньше (см. неоднократные электронные проскоки), гораздо сильней сказываются эффекты их взаимного экранирования. Потеря первых электронов уменьшает экранирование заряда ядра, а это особенно усиливает воздействие ядра на непроникающие d–электронные облака. Энергия (n-1)d–орбиталей дополнительно понижается, они становятся более низколежащими, чем ns–орбиталь, и оставшиеся валентные электроны заселяют d–подуровень. d–электроны друг друга практически не экранируют, поэтому в дальнейшем орбитальный радиус уменьшается, главным образом, только за счет уменьшения межэлектронного отталкивания.
Изменение ионных орбитальных радиусов в периодах, в целом, подчиняется тем же закономерностям, которые характерны для радиусов атомов. Конечно, положение экстремумов (максимумов и минимумов) будут наблюдаться не в начале и конце периодов, а смещены влево или вправо в зависимости от заряда иона.
Менее очевидными представляются закономерности изменения ионных орбитальных радиусов в подгруппах. Их анализ позволяет дополнительно подтвердить подчеркивавшуюся ранее зависимость эффектов 3d– и 4f–сжатия от типа валентных электронов, от их проникающей способности – эффекты сжатия сильней сказываются в тех случаях, когда размер частицы определяется внешними s–электронными облаками. Особенно сильно смена типа внешних электронов влияет на степень лантаноидной контракции:
Таблица 1.8
Влияние электронной конфигурации
на эффекты проникновения
(эффекты сжатия)
| Элемент | Электронная конфигурация | R(орб), Å |
| Sn | 1s22s22p63s23p63d104s24p64d105s25p2 | 1.240 |
| Pb | 1s22s22p63s23p63d104s24p64d104f145s25p65d106s26p2 | 1.315 |
| Sn2+ | 1s22s22p63s23p63d104s24p64d105s2 | 0.997 |
| Pb2+ | 1s22s22p63s23p63d104s24p64d104f145s25p65d106s2 | 0.986 |
| Sn4+ | 1s22s22p63s23p63d104s24p64d10 | 0.458 |
| Pb4+ | 1s22s22p63s23p63d104s24p64d104f145s25p65d10 | 0.558 |

| Рис. 1.15 – Влияние электронных конфигураций атомов (ионов) на закономерности изменения орбитальных радиусов в подгруппах s– и d–элементов. |
Из рисунка дополнительно видно, что изменение ионных радиусов не повторяет полностью изменение атомных:
– размеры более компактных электронных облаков остова меняются слабей;
–после потери сильно проникающих s–электронов эффекты сжатия проявляются более слабо, особенно заметно изменение электронного строения сказывается на лантаноидной контракции.
Дата добавления: 2014-11-13; просмотров: 319; Мы поможем в написании вашей работы!; Нарушение авторских прав |