
КАТЕГОРИИ:
АстрономияБиологияГеографияДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРиторикаСоциологияСпортСтроительствоТехнологияФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Энергий (потенциалов) ионизации
Обычно энергию ионизации определяют как работу, которую нужно совершить (энергию, которую необходимо затратить), чтобы удалить электрон из атома на бесконечно большое расстояние:

Под первой энергией ионизации, как правило, понимают энергию, необходимую для удаления наиболее слабо удерживаемого валентного электрона атома.[14] В многоэлектронных атомах возможен последовательный отрыв всех электронов. При этом каждая последующая энергия ионизации, как нетрудно догадаться, превышает любые предыдущие, т.е. для любого атома:
I1 < I2 < I3 < I4 и т.д.
Объяснить этот факт можно по-разному:
- опираясь на простые электростатические представления, можно утверждать, что отделение отрицательного электрона от нейтрального атома будет происходить легче, чем от все более положительных ионов:
Э  Э+; Э+
Э+; Э+  Э2+; Э2+
Э2+; Э2+  Э3+;…
Э3+;…
- опираясь на квантово-механические, волновые законы движения электронов в атоме, необходимо понимать, что даже самые высоколежащие по энергии электроны (особенно находящиеся на s-орбиталях) какое-то время проводят во внутренних частях электронного облака, взаимно экранируя друг друга. Поэтому удаление любого из них в той или иной степени уменьшит эффект экранирования заряда ядра для всех остальных (особенно валентных) электронов. Их связь с ядром усилится[15], отрыв любого последующего электрона затруднится.
Анализ закономерностей изменения энергий ионизации в периодах и подгруппах периодической системы является не только важной логической (теоретической) задачей, но и позволяет прогнозировать важные химические последствия: способность атомов участвовать в различных вариантах химического взаимодействия (металлическое, ковалентное, ионное…); закономерности перераспределения валентных электронов связанных атомов; способность задействовать соответствующие электроны (орбитали) в связывание, а стало быть, возможность стабилизировать те или иные соединения и т.п.
Прежде чем приступать к поиску и анализу связи энергий ионизаций с расположением атомов в периодической системе, необходимо вспомнить, что точное их описание (расчет) в рамках современной теории для многоэлектронных атомов невозможен. Имеются разные варианты количественных оценок, опирающиеся, чаще всего, на, так называемое, одноэлектронное приближение. Смысл его состоит в том, чтобы предложить алгоритм учета роли других электронов в энергию взаимодействия между ядром атома и рассматриваемым электроном. Как правило, эта задача сводится к выработке правил расчета коэффициента экранирования прочими электронами заряда ядра (к нахождению эффективного заряда ядра для подстановки его в формулы (1.27), стр. 25). Наиболее известные из более-менее простых правил были сформулированы Дж.Слэтером. В рамках данного пособия обсуждать и, тем более, анализировать их нет возможности. Отметим лишь, что расчет констант экранирования должен опираться на вид графиков радиального распределения электронной плотности как экранирующих электронов, так и "отрываемого" (необходимо учесть его способность проникать под экраны внутренних, предвнешних и валентных электронов). Мы же попробуем все это проделать на качественном уровне. Но и в этом случае важно заранее признать, что связь электрона с ядром зависит от нескольких взаимно независимых (в определенной степени) факторов:
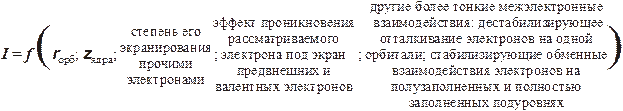
· Орбитальный радиус в значительной степени характеризует общую энергию взаимодействия электрона с зарядом ядра (достаточно сказать, что большую часть времени он проводит на расстояниях близких к rорб).
· Два других фактора определяют вклад взаимодействия с ядром, определяемый схемами радиальных распределений экранирующих и отрываемого электрона. При этом будем исходить из предположения, что "глубокорасположенные" орбитали (электроны) остова экранируют внешние электроны практически 100%-но, и по показателю валентные электроны отличаются незначительно. Предвнешние электроны менее качественно "исполняют роль экрана", поэтому анализом эффекта проникновения под предвнешний слой пренебрегать ни в коем случае нельзя, особенно при следующих условиях:
ü если в предвнешнем слое имеются диффузные плохо экранирующие d10-, f14-конфигурации (тем более, когда они кайносимметричны: 3d10 или 4f14);
ü если приходится анализировать, сравнивать отрыв с валентных орбиталей электронов разного типа, с разной проникающей способностью (она резко уменьшается при переходе от s–электронов к р–электронам; эффектом проникновения d(f)–электронов можно вообще пренебрегать).
· Последний фактор необходимо принимать во внимание, если приходится сравнивать атомы с изменяющимся строением валентного уровня. Электронные конфигурации s2, р3, p6, d5, d10, f7 и f14 отличаются особой дополнительной устойчивостью, что делает соответствующие частицы очень стабильными к нарушению электронного строения (в частности, имеют завышенные энергии ионизации). Причем образование электронной пары на s-орбитали, несмотря на появление межэлектронного отталкивания, все же оказывается стабилизирующим фактором.
Обсудим теперь характер изменения энергий ионизации в малых периодах (рис. 1.16).

| Рис. 1.16 – Закономерности изменения первой (второй) энергии ионизации в малых периодах периодической системы. |
Видно, что в обоих случаях первая энергия ионизации имеет тенденцию к увеличению, что можно объяснить влиянием первых двух факторов (растущий заряд ядра и уменьшающийся орбитальный радиус) при неизменном эффекте экранирования остова (он одинаков – 1s2, 1s22s22р6, соответственно). Уменьшение I1 при переходе Ве→В (Mg→Al) можно объяснить тем, что меняется тип отрываемого электрона: ионизация Ве(Mg) требует нарушения стабильной ns2-конфигурации, в то время как от атома В(Al) удаляется nр1–электрон. Отрыв р–электрона облегчается не только потому, что нарушается высокая стабильность заполненного s–подуровня, но и по причине меньшей проникающей способности р–электрона (связывание с ядром заметно уменьшается). При переходе N→O (P→S) энергия ионизации уменьшается, т.к. нарушается стабильность полузаполненного подуровня и приходится удалять электрон из nр4–конфигурации (с р–орбитали с электронной парой).
Вторые энергии ионизации подчиняются тем же закономерностям с той лишь разницей, что "аномально заниженные" I2 наблюдаются "со сдвигом" на один элемент правее (nр1–конфигурации теперь выполняются у С+(Si+), а nр4 – у F+(Cl+)).
Отрыв электронов от s– и р–элементов больших периодов подчиняются тем же выше описанным закономерностям. А вот анализ энергий ионизации элементов d–рядов требует отдельного и особого разговора (рис.1.17). Явно бросается в глаза, что I1 меняется слабо, трудно выявить какую-либо закономерность. По-нашему мнению, это связано с тем, кроме выше перечисленных причин, в данном случае дополнительно сказывается очень высокая энергетическая близость 3d– и 4s–орбиталей, а также более сильная стабилизация 3d–орбиталей в ионизированных атомах (см. стр.46, 49, 50). Как следствие, в данном случае I1 соответствует более сложному процессу: отрыв электрона (причем с более высоколежащей 3d–орбитали) и последующие 4s→3d электронные переходы (в атоме Zn первая энергия ионизации, безусловно, соответствует удалению 4s–электрона, возможно, что из атомов Сг и Cu также первым теряется электрон с 4s–орбитали). Таким образом, для большинства 3d–элементов отрыв первого электрона можно представить в виде следующей схемы:

По периоду 3d–подуровень постепенно стабилизируется, т.к. при практически не меняющемся эффекте экранирования растет заряд ядра и уменьшаются орбитальные радиусы атомов). Поэтому отрыв электрона постепенно затрудняется, растут значения Е1. В то же время растет и компенсация затрат энергии на удаление электрона, т.к. в возбужденном ионе (Э+)* энергия 3d–орбиталей понижается все сильней и, соответственно, 4s→3d-переход делается все более выгодным. Таким образом, в ионе Э+суммарная энергия оставшихся электронов становится ниже не только за счет уменьшения эффекта экранирования, но и за счет нового заселения валентных орбиталей. Энергетические эффекты этих двух этапов превращения оказываются сопоставимыми, и I1 оказывается мало меняющейся величиной (некоторую волнообразность, вторичную периодичность изменения I1 в ряду Sc – Cu можно также объяснить в рамках данного подхода). Завышенная энергия ионизации цинка вызвана необходимостью удаления электрона из стабилизированной 4s–конфигурации.
Изменение I2, I3 и других энергий ионизаций представляют собой гораздо более простые закономерности, полностью согласующиеся с логикой предыдущего разговора: второй, третий,… электроны удаляются уже с 3d–орбиталей без последующих компенсаций за счет 4s→3d-переходов. Ну а отрыв 3d–электронов постепенно затрудняется по перечисленным выше причинам. Аномально завышенными оказываются энергии ионизации, требующие удаления электрона из стабилизированных конфигураций:
3d5(I2 для Cr, I3 для Mn) и 3d10(I2 для Cu, I3 для Zn).

| Рис. 1.17 – Изменение первых трех энергий ионизации в ряду d– ир –элементов четвертого периода периодической системы. |
Обсудим теперь изменение энергий ионизации в подгруппах периодической системы. Вначале следует отметить, что:
ü в подгруппах изменение энергий ионизации также подчиняется своим внутренним особенностям, часто можно наблюдать признаки вторичной периодичности;
ü закономерности изменения энергий ионизации элементов главных подгрупп могут быть объяснены сравнительно легко, в побочных подгруппах анализ низших энергий ионизации осложняется межорбитальными электронными переходами, которые часто происходят при удалении первого электрона;
ü для элементов подгрупп тонкие межэлектронные взаимодействия (стр. 65) практически никогда не влияют на изменение энергий ионизации, т.к. в подавляющем большинстве случаев (кроме некоторых побочных подгрупп) валентные орбитали атомов заселены одинаково.

| Рис. 1.18 – Связь между первыми энергиями ионизации и орбитальными радиусами атомов в подгруппах s–элементов. |
Как видно из рис.1.18, энергии ионизации в подгруппах s–элементов хорошо согласуются с характером изменения орбитальных радиусов, которые, в свою очередь, в целом немонотонно растут: видны последствия 2р–сжатия (Li–Na), 3d–сжатия (K–Rb, Ca–Sr) и 4f–сжатия (Cs–Fr, Ba–Ra). Анализировать влияние других факторов (zядра, эффект его экранирования и проникающую способность) не имеет большого смысла по двум причинам:
ü учет этих факторов не изменит, а только закрепит наблюдаемую картину;
ü в случае s–элементов орбитальный радиус в максимальной степени формируется под влиянием упомянутых причин ввиду высокого эффекта проникновения s–электронов (т.е. rорб сам в значительной степени является функцией этих факторов).
В подгруппах р–элементов ситуация более сложная уже потому, что необходимо иметь информацию о валентных возможностях как р– (первые или низшие энергии ионизации), так и s–электронов (необходим анализ высших энергий ионизации). Поскольку эффект проникновения р–электронов невелик[16], можно считать, что соответствующие их отрыву энергии ионизации будут определяться только орбитальными радиусами (полагая, что растущий по подгруппе zядра компенсируется растущим одновременно числом экранирующих электронов – растущим эффектом экранирования). Как следствие, схемы изменения первых энергий ионизации зеркально симметричны изменению радиусов (рис.1.19 и 1.20). Для анализа I2 необходимо принимать во внимание орбитальные радиусы Э+. По мере удаления р–электронов на значения орбитальных радиусов все большую роль начинают играть валентные s–электроны, а, следовательно, более заметными становятся эффекты сжатия (см. стр. 59, 62). Это равносильно растущему вкладу эффекта проникновения. Поначалу (I2) это приводит к завышению энергий ионизации при переходе к элементу с заполненными 4f14–орбиталями в предвнешнем слое (в п/гр С и N). Когда дело доходит до отрыва валентных s–электронов (в п/гр В – I2, в п/гр С – I3), то аномальный рост соответствующих энергий ионизации наблюдается и при появлении заполненного 3d10–подуровня (Al→Ga, Si→Ge). При движении по ряду р–элементов проникновение постепенно "затухает" (особенно для р–электронов и особенно под 3d10–подуровень). Поэтому Iр-ē в подгруппах N–He меняются строго в соответствии со схемой изменения rорб. На Is-ē эффект проникновения сказывается сильней: при переходе к последнему элементу подгруппы (Tl–Pb–Bi–Po–At) всегда наблюдается рост высших энергий ионизации, проникновение под 3d10–подуровень сказывается слабей и вызывает рост Is-ē только в подгруппах бора и углерода (рис. 1.20).
Как уже отмечалось ранее, анализ энергий ионизации позволяет делать вывод о валентных возможностях соответствующих орбиталей, о способности реализовать положительные степени окисления. Из полученных горизонтальных и вертикальных зависимостей можно сделать вывод, что
легче всего теряют свои валентные электроны, участвуя в образовании самых разнообразных типах связей (обычно ионных или металлических) и приобретая положительные заряды, s–элементы. В рядах р–элементов достижение положительных степеней окисления должно постепенно затрудняться. Причем, как следует из анализа высших энергий ионизации (рис. 1.20) особенно сильно по периодам стабилизируются s–орбитали р–элементов II–го периода, что приводит к резкому снижению их роли в связывании, без чего невозможна реализация групповой степени окисления (соединения азота (+V) очень нестабильны, а соединения кислорода (+VI) вообще неизвестны). Похожая ситуация, но в меньшей степени, характерна и для элементов IV-V-VIпериодов.

| Рис. 1.19 – Изменение орбитальных радиусов элементов подгрупп углерода и кислорода. |

| Рис. 1.20 – Изменение низших и высших энергий ионизации в подгруппах углерода и кислорода. Все графики приведены в одинаковом масштабе, но для подгруппы кислорода схемы смещены друг относительно друга, чтобы их можно было свести на один рисунок. |

| Рис. 1.21 –Принципиальный вид изменения энергий ионизации и орбитальных радиусов элементов побочных подгрупп. |
Подробный анализ Ii в побочных подгруппах выходит за рамки данного пособия. Отметим лишь, что в большинстве случаев первые и высшие энергии ионизации меняются, как показано на рис. 1.21. Завышенная I1дляd–элемента VI–го периода объясняется высоким эффектом проникновения валентных s–электронов под 4f14–экран предвнешнего слоя (с этим же, собственно, связано уменьшение орбитального радиуса соответствующих элементов – лантаноидная контракция). Высшие энергии ионизации соответствуют отрыву d–электронов и уменьшаются в соответствие с ростом радиусов ионов (эффекты сжатия ни ионные радиусы влияют гораздо слабей из-за пренебрежимо низкой проникающей способности электронов d–подуровня). Изменение Id-ē явно свидетельствует о том, что валентные возможности d–орбиталей растут, что должно способствовать стабилизации высших степеней окисления.
Итак, можно сказать, что на основе современных представлений об электронном строении атомов удается дать объяснение даже деталям в изменении такого важного, объективно измеряемого свойства, как энергии ионизации и, тем самым, прогнозировать тенденции развития многих атомных свойств, связанных с орбитальной энергией. Одним из таких важных свойств, как будет показано чуть ниже, является электроотрицательность атомов. Но вначале кратко обсудим характер изменения сродства к электрону.
Дата добавления: 2014-11-13; просмотров: 289; Мы поможем в написании вашей работы!; Нарушение авторских прав |