
КАТЕГОРИИ:
АстрономияБиологияГеографияДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРиторикаСоциологияСпортСтроительствоТехнологияФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Основные типы и номенклатура комплексных соединений.
К основным типам комплексных соединений относятся следующие.
Аммиакаты — комплексы, в которых лигандами служат молекулы аммиака, например:  . Известны комплексы, аналогичные аммиакатам, в которых роль лиганда выполняют молекулы аминов:
. Известны комплексы, аналогичные аммиакатам, в которых роль лиганда выполняют молекулы аминов:  (метиламин),
(метиламин), 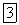 (этиламин),
(этиламин),  (этилендиамин, условно обозначаемый
(этилендиамин, условно обозначаемый  ) и др. Такие комплексы называют аминатами.
) и др. Такие комплексы называют аминатами.
Аквакомплексы — в которых лигандом выступает вода:  и др. Находящиеся в водном растворе гидратированные катионы содержат в качестве центрального звена аквакомплекс. В кристаллическом состоянии некоторые из аквакомплексов удерживают и кристаллизационную воду, например:
и др. Находящиеся в водном растворе гидратированные катионы содержат в качестве центрального звена аквакомплекс. В кристаллическом состоянии некоторые из аквакомплексов удерживают и кристаллизационную воду, например:  . Кристаллизационная вода не входит в состав внутренней сферы, она связана менее прочно, чем координированная, и легче отщепляется при нагревании.
. Кристаллизационная вода не входит в состав внутренней сферы, она связана менее прочно, чем координированная, и легче отщепляется при нагревании.
Ацидокомплексы. В этих комплексах лигандами являются анионы. К ним относятся комплексы типа двойных солей, например  (их можно представить как продукт сочетания двух солей —
(их можно представить как продукт сочетания двух солей —  и т. п.), комплексные кислоты —
и т. п.), комплексные кислоты —  , гидроксокомплексы —
, гидроксокомплексы —  и др.
и др.
Между этими классами существуют переходные ряды, которые включают комплексы с различными лигандами. О таких комплексах мы уже упоминали. Приведем переходный ряд между аммиакатами и ацидокомплексами  .
.
Циклические, или хелатные (клешневидные), комплексные соединения. Они содержат  или полидентатный лиганд, который как бы захватывает центральный атом подобно клешням рака:
или полидентатный лиганд, который как бы захватывает центральный атом подобно клешням рака:

В этих комплексах символом М обозначен атом металла, а стрелкой — донорно-акцепторная связь. Примерами таких комплексов служат оксалатный комплекс  и этилендиаминовый комплекс
и этилендиаминовый комплекс  . К группе хелатов относятся и внутрикомплексные соединения, в которых центральный атом входит в состав цикла, образуя ковалентные связи с лигандами разными способами: донорно-акцепторным и за счет неспаренных атомных электронов. Комплексы такого рода весьма характерны для аминокарбоновых кислот.
. К группе хелатов относятся и внутрикомплексные соединения, в которых центральный атом входит в состав цикла, образуя ковалентные связи с лигандами разными способами: донорно-акцепторным и за счет неспаренных атомных электронов. Комплексы такого рода весьма характерны для аминокарбоновых кислот.
Простейший их представитель — амииоуксусная кислота (глицин)  — образует хелаты с ионами
— образует хелаты с ионами  , например:
, например:

Известны также комплексы с более сложными амннокарбоно-выми кислотами и их аналогами. Такие лиганды называются комплексонами. Двухзарядный анион этилендиамиптетрауксусной кислоты, называемый в виде двунатриевой соли комплексоном III, или трилоном Б, дает с двухвалетным металлом комплекс типа:

Хелатные соединения отличаются особой прочностью, так как центральный атом в них как бы «блокирован» циклическим лигандом. Наибольшей устойчивостью обладают хелаты с пяти- и шестичленными циклами. Комплексоны настолько прочно связывают катионы металлов, что при их добавлении растворяются такие плохо растворимые вещества, как сульфаты кальция и бария, оксалаты и карбонаты кальция. Поэтому их применяют для умягчения воды, для маскировки «лишних» ионов металла при крашении и изготовлении цветной пленки. Большое применение они находят и в аналитической химии.
215.4 ПРИРОДА ХИМИЧЕСКОЙ СВЯЗИ В КОМПЛЕКСНЫХ СОЕДИНЕНИЯХ. ВТОРИЧНАЯ ДИССОЦИАЦИЯ КОМПЛЕКСОВ. КОНСТАНТА НЕСТОЙКОСТИ
Согласно методу валентных связей *, образование комплексных соединений * осуществляется за счет донорно-акцепторного *взаимодействия между комплексообразователем * и лигандами *. Обычно центральный атом имеет свободные орбитали *, а лигандыимеют неподеленные электронные пары. В образовании такой координационной связи могут участвовать ns-, np-, nd- или (n–1)d-орбитали, где n – номер внешнего электронного слоя комплексообразователя. Координационное число * определяется гибридизацией *орбиталей центрального атома:
| КЧ | |||
| Гибридизация | sp | sp3, dsp2 | sp3d2, d2sp3 |
Для примера рассмотрим образование координационных связей в ионе [Zn(NH3)4]2+. Здесь акцептором является ион Zn2+, имеющий вакантные орбитали на четвертом электронном слое и полностью занятый третий электронный слой. Четыре ковалентных связи * образуются с участием одной 4s- и трех 4p-орбиталей, которые перекрываются с орбиталями молекул аммиака (донор),содержащими неподеленные электронные пары:

Валентные орбитали цинка подвергаются sp3-гибридизации, поэтому лиганды (NH3) расположены в вершинах тетраэдра, в центре которого находится ион Zn2+.
Донорно-акцепторная связь в комплексных соединениях является весьма прочной, однако наряду с диссоциацией, в которой отщепляются ионы внешней сферы, в очень незначительной степени разрушается также внутренняя сфера комплекса *:
[Ag(NH3)2]Cl → [Ag(NH3)2]+ + Cl– (первичная диссоциация)
[Ag(NH3)2]+  Ag+ + 2 NH3 (вторичная диссоциация)
Ag+ + 2 NH3 (вторичная диссоциация)
Вторичная диссоциация подчиняется закону действия масс * и характеризуется соответствующей константой равновесия *, которая называется константой нестойкости комплексного иона:

Наиболее устойчивые комплексные соединения имеют наименьшие константы нестойкости. С помощью этих величин можно предсказать течение реакций между комплексными соединениями. Реакция протекает в сторону продуктов с меньшими константами нестойкости. Например, для иона [Ag(NH3)2]+ Kнест=6,8·10–8, а для иона аммония NH4+ Kнест=5,4·10–10, поэтому под действием кислот аммиакат серебра разрушается с образованием ионов Ag+ и NH4+:
[Ag(NH3)2]+ + 2 H+  Ag+ + 2 NH4+
Ag+ + 2 NH4+
Для комплекса [Pt(NH3)4]2+ Kнест=5·10–34, поэтому он не разрушается даже в концентрированной соляной кислоте.
Иногда вместо константы нестойкости используют обратную ей величину, называемую константой устойчивости: Kуст=1/Kнест. Значения этих констант можно найти в справочнике.
Дата добавления: 2014-12-30; просмотров: 94; Мы поможем в написании вашей работы!; Нарушение авторских прав |