
КАТЕГОРИИ:
АстрономияБиологияГеографияДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРиторикаСоциологияСпортСтроительствоТехнологияФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Диссоциация комплексных соединений в растворах.
Мы уже говорили о том, что внутренняя и внешняя сфера комплексного соединения сильно различаются по  частицы, находящиеся во внешней сфере, связаны с комплексным ионом преимущественно электростатическими силами и легко отщепляются в водном растворе.
частицы, находящиеся во внешней сфере, связаны с комплексным ионом преимущественно электростатическими силами и легко отщепляются в водном растворе.
Эта диссоциация называется первичной, она протекает почти нацело, по типу диссоциации сильных электролитов. Лиганды, находящиеся во внутренней сфере, связаны с центральным атомом значительно прочнее и отщепляются лишь в небольшой степени. Обратимый распад внутренней сферы комплексного соединения носит название вторичной диссоциации. Например, диссоциацию комплекса  можно записать так:
можно записать так:

Вторичная диссоциация характеризуется наличием равновесия между комплексной частицей, центральным ионом и лигандами. В этом можно убедиться на основании следующих реакций. Если на раствор, содержащий комплексный 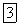 , подействовать раствором какого-нибудь хлорида, то осадка не образуется, хотя из растворов обычных солей серебра при добавлении хлоридов выделяется осадок хлорида серебра.
, подействовать раствором какого-нибудь хлорида, то осадка не образуется, хотя из растворов обычных солей серебра при добавлении хлоридов выделяется осадок хлорида серебра.
Очевидно, концентрация ионов серебра в аммиачном растворе слишком мала, чтобы при введении в него даже избытка хлорид-ионов можно было бы достигнуть значения произведения растворимости хлорида серебра (  ). Однако после прибавления к раствору комплекса иодида калия выпадает осадок иодида серебра. Это доказывает, что ионы серебра все же имеются в растворе. Как ни мала их концентрация, но она оказывается достаточной для образования осадка, так как произведение растворимости иодида серебра
). Однако после прибавления к раствору комплекса иодида калия выпадает осадок иодида серебра. Это доказывает, что ионы серебра все же имеются в растворе. Как ни мала их концентрация, но она оказывается достаточной для образования осадка, так как произведение растворимости иодида серебра  составляет только
составляет только  , т. е. значительно меньше, чем у хлорида серебра. Точно так же при действии сероводорода получается осадок сульфида серебра
, т. е. значительно меньше, чем у хлорида серебра. Точно так же при действии сероводорода получается осадок сульфида серебра  , произведение растворимости которого равно
, произведение растворимости которого равно  .
.
Уравнение протекающих реакций можно записать так:

Диссоциация ионов  , согласно приведенному выше уравнению, как и диссоциация всякого слабого электролита, подчиняется закону действия масс и может быть охарактеризована соответствующей константой равновесия, называемой константой нестойкости комплексного иона:
, согласно приведенному выше уравнению, как и диссоциация всякого слабого электролита, подчиняется закону действия масс и может быть охарактеризована соответствующей константой равновесия, называемой константой нестойкости комплексного иона:

Константы нестойкости для различных комплексных ионов весьма различны и могут служить мерой устойчивости комплекса. Константы нестойкости, в выражения которых входят концентрации ионов и молекул, называются «концентрационными». Более строгими и не зависящими от концентраций и ионной силы раствора являются константы нестойкости, содержащие вместо концентраций активности ионов и молекул. В разбавленных растворах эти два различных выражения констант нестойкости совпадают друг с другом,
Из приведенной формулы видно, что чем меньше концентрация продуктов распада, т. е. чем устойчивее комплекс, тем меньше его константа нестойкости. Наиболее устойчивые в растворах комплексные частицы имеют наименьшие константы нестойкости.  однотипных соединений
однотипных соединений

устойчивость комплекса возрастает при переходе от  к
к  настолько стоек, что даже прибавление иодида калия к раствору комплексной соли не приводит к образованию осадка иодида серебра. Но при действии сероводорода, ввиду ничтожно малого значения произведения растворимости сульфида серебра, все же выпадает осадок сульфида серебра.
настолько стоек, что даже прибавление иодида калия к раствору комплексной соли не приводит к образованию осадка иодида серебра. Но при действии сероводорода, ввиду ничтожно малого значения произведения растворимости сульфида серебра, все же выпадает осадок сульфида серебра.
В последнее время для характеристики устойчивости комплексных соединений предпочитают пользоваться величиной, обратной константе нестойкости, называемой константой устойчивости. Для иона  константа устойчивости равна:
константа устойчивости равна:

До сих пор шла речь об общих константах нестойкости и устойчивости, относящихся к распаду комплекса на конечные продукты. В действительности же в растворах имеет место ступенчатая диссоциация комплекса, аналогично ступенчатой диссоциации слабых электролитов, например многоосновных кислот.
Так, в водном растворе  присутствуют в различных соотношениях все комплексы, участвующие в равновесиях:
присутствуют в различных соотношениях все комплексы, участвующие в равновесиях:

Каждое из этих равновесий характеризуется своей ступенчатой константой нестойкости  и т. д. По мере отщепления хлорид-ионов заряд комплекса становится все более положительным, а число ионов
и т. д. По мере отщепления хлорид-ионов заряд комплекса становится все более положительным, а число ионов  в комплексе уменьшается. В результате последовательный отрыв хлорид-ионов все в большей степени затрудняется. Поэтому между ступенчатыми константами нестойкости иона
в комплексе уменьшается. В результате последовательный отрыв хлорид-ионов все в большей степени затрудняется. Поэтому между ступенчатыми константами нестойкости иона  имеет место соотношение:
имеет место соотношение:  .
.
Такое изменение в значениях последовательных констант нестойкости носит общий характер  . Значение общей константы нестойкости равно произведению всех ступенчатых констант.
. Значение общей константы нестойкости равно произведению всех ступенчатых констант.
Значения констант нестойкости и устойчивости приводятся в справочниках по химии. С помощью этих величин можно предсказать течение реакций между комплексными соединениями: при сильном различии констант устойчивости реакция пойдет в сторону образования комплекса с большей константой устойчивости или, что равноценно, с меньшей константой нестойкости. Например, для иона  , а для иона
, а для иона  поэтому под действием кислот аммиакат серебра разрушается с образованием ионов
поэтому под действием кислот аммиакат серебра разрушается с образованием ионов  и
и  :
:

Комплекс же  не разрушается при комнатной температуре даже в концентрированной соляной кислоте.
не разрушается при комнатной температуре даже в концентрированной соляной кислоте.
Процессы комплексообразования широко используются в аналитической химии. При выборе условий наиболее эффективного разделения ионов исходят из соотношения констант устойчивости образуемых ими комплексных соединений.
Например, катионы  дают устойчивые растворимые аммиакаты, а
дают устойчивые растворимые аммиакаты, а  менее склонны к комплексообразованию с аммиаком и осаждаются при действии аммиака в виде гидроксидов. Это позволяет разделить действием аммиака эти две группы катионов. Подобного рода соображения могут быть использованы для разделения анионов: так, можно осадить смесь хлоридов и иодидов в виде
менее склонны к комплексообразованию с аммиаком и осаждаются при действии аммиака в виде гидроксидов. Это позволяет разделить действием аммиака эти две группы катионов. Подобного рода соображения могут быть использованы для разделения анионов: так, можно осадить смесь хлоридов и иодидов в виде  и
и  и далее обработать ее аммиаком — в раствор перейдет только
и далее обработать ее аммиаком — в раствор перейдет только  останется в осадке. Для того чтобы растворить
останется в осадке. Для того чтобы растворить  , нужно применить лиганд, связывающий
, нужно применить лиганд, связывающий  значительно прочнее, например
значительно прочнее, например  , так как для комплекса
, так как для комплекса  . В растворе KCN иодид серебра растворяется с образованием
. В растворе KCN иодид серебра растворяется с образованием  :
:

Константы устойчивости однотипных комплексов зависят от ряда факторов, и прежде всего от природы центрального атома и лигандов. В комплексах с центральными ионами, обладающими слабой поляризующей способностью, например с ионами щелочных и щелочноземельных металлов, устойчивость растет по мере увеличения интенсивности электростатического взаимодействия между центральным ионом и лигандами: чем больше заряды центрального иона и лигандов и чем меньше их радиусы, тем выше устойчивость комплексов. Эти катионы образуют более устойчивые комплексы с лигандами, содержащими элементы малых периодов (кислород, азот) и с ионами  .
.
Для другой большой группы комплексообразователей — катионов платиновых металлов, ионов  , у которых поляризующая способность выражена сильно и характер связи центрального атома с лигандами приближается к ковалентному, — наиболее устойчивы комплексы с легко поляризующимися лигандами. К последним относятся, например, ионы I- и лиганды, содержащие атомы Р и
, у которых поляризующая способность выражена сильно и характер связи центрального атома с лигандами приближается к ковалентному, — наиболее устойчивы комплексы с легко поляризующимися лигандами. К последним относятся, например, ионы I- и лиганды, содержащие атомы Р и  .
.
237.11. ПРИМЕНЕНИЕ КОМПЛЕКСОНОВ И КОМПЛЕКСОНАТОВ В МЕДИЦИНЕ
Молекулы комплексонов практически не подвергаются расщеплению или какому-либо изменению в биологической среде, что является их важной фармакологической особенностью. Комплексоны нерастворимы в липидах и хорошо растворимы в воде, поэтому они не проникают или плохо проникают через клеточные мембраны, а следовательно: 1) не выводятся кишечником; 2) всасывание ком-плексообразователей происходит только при их инъекции (лишь пеницилламин принимают внутрь); 3) в организме комплексоны циркулируют по преимуществу во внеклеточном пространстве; 4) выведение из организма осуществляется главным образом через почки. Этот процесс происходит быстро.
Вещества, устраняющие последствия воздействия ядов на биологические структуры и инактивирующие яды посредством химических реакций, называют антидотами.
Одним из первых антидотов, который применили в хелатотерапии, является британский антилюизит (БАЛ). В настоящее время применяют унитиол:

Этот препарат эффективно выводит из организма мышьяк, ртуть, хром и висмут. Наиболее широко используют при отравлении цинком, кадмием, свинцом и ртутью комплексоны и комплексонаты. Применение их основано на образовании более прочных комплексов с ионами металлов, чем комплексы этих же ионов с серосодержащими группами белков, аминокислот и углеводов. Для выведения свинца используют препараты на основе ЭДТА. Введение в организм в больших дозах препаратов опасно, так как они связывают ионы кальция, что приводит к нарушению многих функций. Поэтому применяют тетацин (СаNa2ЭДТА), который используют для выведения свинца, кадмия, ртути, иттрия, церия и других редкоземельных металлов и кобальта.

Со времени первого лечебного использования тетацина в 1952 году этот препарат нашел широкое применение в клинике профессиональных заболеваний и продолжает оставаться незаменимым антидотом. Механизм действия тетацина весьма интересен. Ионы-токсиканты вытесняют координированный ион кальция из тетацина в связи с образованием более прочных связей с кислородом и ЭДТА. Ион кальция, в свою очередь, вытесняет два оставшихся иона натрия:

Тетацин вводят в организм в виде 5-10% раствора, основой которого является физиологический раствор. Так, уже через 1,5 ч после внутрибрюшинной инъекции в организме остается 15% введенной дозы тетацина, через 6 ч - 3%, а через 2 сут - только 0,5%. Эффективно и быстро действует препарат при применении ингаляционного метода введения тетацина. Он быстро всасывается и долго циркулирует в крови. Кроме того, тетацин используют при защите от газовой гангрены. Он ингибирует действие ионов цинка и кобальта, которые являются активаторами фермента лецитиназы, являющегося токсином газовой гангрены.
Связывание токсикантов тетацином в малотоксичный и более прочный хелатный комплекс, который не разрушается и легко выводится из организма через почки, обеспечивает детоксикацию и сбалансированное минеральное питание. Близким по структуре и составу к пре-
паратам ЭДТА является натриево-кальциевая соль диэтилентриамин-пентауксусной кислоты (СаNa3ДТПА) - пентацин и натриевая соль диэтилентриаминпентафосфоновой кислоты (Na6ДТПФ) - тримефа-цин. Пентацин применяют преимущественно при отравлениях соединениями железа, кадмия и свинца, а также для удаления радионуклидов (технеция, плутония, урана).

Натриевая соль этилендиаминдиизопропилфосфоновой кислоты (СаNa2ЭДТФ)фосфицин успешно используется для выведения из организма ртути, свинца, берилия, марганца, актиноидов и других металлов. Комплексонаты весьма эффективны для удаления некоторых токсичных анионов. Например, этилендиаминтетраацетат кобальта (II), образующий смешанно-лигандный комплекс с CN-, может быть рекомендован в качестве антидота при отравлениях цианидами. Аналогичный принцип лежит в основе способов выведения токсичных органических веществ, в том числе пестицидов, содержащих функциональные группировки с донорными атомами, способными к взаимодействию с металлом комплексоната.
Эффективным препаратом является сукцимер (димеркаптоянтарная кислота, димеркаптосукциновая кислота, хемет). Он прочно связывает практически все токсиканты (Hg, As, Pb, Cd), но выводит из организма ионы биогенных элементов (Cu, Fe, Zn, Co), поэтому почти не применяется.
Фосфоросодержащие комплексонаты являются мощными ингибиторами кристаллообразования фосфатов и оксалатов кальция. В качестве антикальцифицирующего препарата при лечении мочекаменной болезни предложен ксидифон - калиево-натриевая соль ОЭДФ. Дифосфонаты, кроме того, в минимальных дозах увеличивают включение кальция в костную ткань, предупреждают патологический выход его из костей. ОЭДФ и другие дифосфонаты предотвращают различные виды остеопороза, включая почечную остеодистрофию, периоденталь-
ную деструкцию, также деструкцию пересаженной кости у животных. Описан также антиатеросклеротический эффект ОЭДФ.
В США предложен ряд дифосфонатов, в частности ОЭДФ, в качестве фармацевтических препаратов для лечения человека и животных, страдающих метастазированным раком костей. Регулируя проницаемость мембран, дифосфонаты способствуют транспортировке противоопухолевых лекарств в клетку, а значит, и эффективному лечению различных онкологических заболеваний.
Одной из актуальных проблем современной медицины является задача экспрессной диагностики различных заболеваний. В этом аспекте несомненный интерес представляет новый класс препаратов, содержащих катионы, способные выполнять функции зонда - радиоактивных магниторелаксационных и флюоресцентных меток. В качестве основных компонентов радиофармацевтических препаратов используются радиоизотопы некоторых металлов. Хелатирование катионов этих изотопов комплексонами позволяет повысить их токсикологическую приемлемость для организма, облегчить их транспортировку и обеспечить в известных пределах избирательность концентрации в тех или иных органах.
Приведенные примеры отнюдь не исчерпывают всего многообразия форм применения комплексонатов в медицине. Так, дикалиевая соль этилендиаминтетраацетата магния используется для регулирования содержания жидкости в тканях при патологии. ЭДТА применяется в составе антикоагулянтных суспензий, используемых при разделении плазмы крови, в качестве стабилизатора аденозинтрифосфата при определении глюкозы в крови, при осветлении и хранении контактных линз. При лечении ревматоидных заболеваний широко используют дифосфонаты. Они особенно эффективны в качестве противоартрит-ных средств в сочетании с противовоспалительными средствами.
24ХИМИЧЕСКАЯ ТЕРМОДИНАМИКА
Термодинамика – наука о взаимопревращениях различных форм энергии и законах этих превращений. Термодинамика базируется только на экспериментально обнаруженных объективных закономерностях, выраженных в двух основных началах термодинамики.
Термодинамика изучает:
1. Переходы энергии из одной формы в другую, от одной части системы к другой;
2. Энергетические эффекты, сопровождающие различные физические и химические процессы и зависимость их от условий протекания данных процессов;
3. Возможность, направление и пределы самопроизвольного протекания процессов в рассматриваемых условиях.
Необходимо отметить, что классическая термодинамика имеет следующие ограничения:
1. Термодинамика не рассматривает внутреннее строение тел и механизм протекающих в них процессов;
2. Классическая термодинамика изучает только макроскопические системы;
3. В термодинамике отсутствует понятие "время".
Дата добавления: 2014-12-30; просмотров: 245; Мы поможем в написании вашей работы!; Нарушение авторских прав |