
КАТЕГОРИИ:
АстрономияБиологияГеографияДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРиторикаСоциологияСпортСтроительствоТехнологияФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Лекция №2: Основные законы общей химии. Стехиометрия. Химический эквивалент.
1. Петь перед литургией каждое воскресенье параклис Божией Матери без упущения. «Если будут свято исполнять это, то никакие беды обитель не постигнут!» — говорил батюшка. «Если же оставят, то без беды беду наживут!» — подтверждал он несколько раз Серафимо-Дивеева монастыря протоиерею отцу Василию Садовскому.
2. Постоянно, и день и ночь, читать Псалтирь в нижней Рождества Богородицы церкви: «Она вечно обитель питать будет, батюшка!» — тоже несколько раз подтвердил он протоиерею Василию Садовскому.
3. Церковные должности дьячка и пономаря и клиросные чтобы исполняли сами сестры, девицы Мельничной обители; точно так же как на все начальнические послушания преподобный Серафим приказал назначать только девиц и никоим образом не вдов.
4. Чтобы никогда сестры не жили в келлии по одной, точно так же во время богослужений не оставались бы по одной и никуда не выходили бы и не выезжали по одной; чтобы сестры кушали не стесняясь, когда и сколько угодно, хотя бы даже и ночью.
5. Приобщаться всем неопустительно во все святые посты, а по желанию и во все двунадесятые праздники, не мучая себя мыслию, что недостоин, «так как не следует пропускать случая, как можно чаще пользоваться благодатию, даруемой приобщением Святых Христовых Таин. Стараясь по возможности сосредоточиться в смиренном сознании всецелой греховности своей, с упованием и твердою верою в неизреченное Божие милосердие, следует приступить к искупляющему все и всех Святому Таинству».
6. Перед образом местным Спасителя в Рождественской церкви неугасимо гореть свече, а перед местной иконою Богоматери в той же церкви неугасимо гореть лампаде.
7. Все вышесказанное как заповедано батюшкой, преподобным Серафимом, так и соблюдалось в Серафимо-Дивеевском монастыре.
Санкт-Петербургский государственный горный институт
имени Г.В. Плеханова (технический университет)
Кафедра общей и физической химии
КОНСПЕКТ ЛЕКЦИЙ
По общей химии
для студентов 1 курса
Санкт-Петербург
План лекций
| № п/п | Тема лекции | № стр. |
| Основные классы химических соединений, номенклатура. | ||
| Основные законы общей химии. Стехиометрия. Химический эквивалент. | ||
| Газовые законы. Основные газовые процессы. | ||
| Строение атома. | ||
| Строение атома (заключение). Химическая связь. Основные типы химической связи. | ||
| Периодический закон и периодическая система элементов Д.И. Менделеева. | ||
| Основы термодинамики. I,II и III начало термодинамики. | ||
| Основы термодинамических расчетов. | ||
| Химическая кинетика и химическое равновесие. | ||
| Теория электролитической диссоциации. Электролиты. | ||
| Водородный показатель кислотности и щелочности водных растворов. Растворимость. | ||
| Гидролиз солей. | ||
| Окислительно-восстановительные реакции. | ||
| Растворы. Способы выражения их концентрации. | ||
| Классификация растворов. Коллигативные свойства растворов. | ||
| Основы химии промышленных взрывчатых веществ. | ||
| Расчеты кислородных балансов ВВ и тепловых эффектов реакций взрыва. |
Лекция №1: Основные классы неорганических соединений, номенклатура.
Основными классами неорганических соединений являются оксиды, кислоты, соли и основания.
Оксиды представляют собой соединения элементов с кислородом. Оксиды подразделяют на солеобразующие и несолеобразующие. Солеобразующие оксиды делят на основные (образуют соли с кислотами), кислотные (образуют соли с основаниями) и амфотерные (образуют соли как с кислотами, так и с основаниями). Основным оксидам отвечают основания, кислотным – кислоты, а амфотерным – гидраты, которые проявляют как кислотные, так и амфотерные свойства. Кислотные оксиды представляют собой ангидриды кислот (SO2 – серный ангидрид, N2O5 – азотный ангидрид).
Примеры: N2O, NO - несолеобразующие оксиды; SO3, SiO2 - кислотные оксиды; СаО, МgО – основные оксиды и т.д.
В настоящее время общепринятой является международная номенклатура оксидов. Согласно международной номенклатуре в названии оксида указывается валентность элемента: СuO и Cu2O – оксиды меди [II] и [III] соответственно. Существует также русская номенклатура, согласно которой окисью называется единственно возможный оксид элемента, в остальных случаях название дается в соответствии с числом атомов кислорода. Оксиды, в которых элемент проявляет низшую валентность, называются закисями.
Примеры: MgO – окись магния; NiO – одноокись никеля; Ni2O3 – полутораокись никеля; Сu2О – полуокись меди.
Пероксиды (перекиси) металлов являются солями перекиси водорода Н2О2 и лишь формально относятся к оксидам. Приставка пер в названии соединений обычно указывает на принадлежность соединения к перекисным, но существуют исключения: соли кислот НMnO4 (перманганаты) и НСlO4 (перхлораты) перекисными не являются, а приставка пер в названии этих соединений указывает на максимальную насыщенность соединений кислородом.
Гидроксиды (основания) классифицируют по их силе (сильные – все щелочи кроме NH4OH и слабые), а также по растворимости в воде (растворимые – щелочи и нерастворимые). Важнейшими щелочами являются КОН (едкое кали) и NaOH (едкий натр).
В состав кислот входит водород, способный замещаться металлом, а также кислотный остаток. Коэффициент х, отвечающий количеству атомов водорода, а, следовательно, равный валентности кислотного остатка, называют основностью кислоты. Кислоты классифицируют по их силе (H2SO4, HNO3 – сильные кислоты; HCN – слабая кислота), на кислородсодержащие (H2SO4, HNO3) и бескислородные (HCN, HI); а также по основности (х) -
HCN – одноосновная кислота, H2SO3 – двухосновная кислота, H3РO4 – трехосновная кислота. Важнейшим свойством кислот является их способность образовывать соли с основаниями. Названия кислот образуют от того элемента, которым образована кислота, при этом названия бескислородных кислот оканчивается словом водород (HCN –циановодород или синильная кислота). Названия кислородсодержащих кислот образуют от того элемента, которым образована кислота, с добавлением слова кислота (H3AsO4 – мышьяковая кислота, H2CrO4 – хромовая кислота). В случаях, когда один элемент образует несколько кислот различие между кислотами проявляют в окончаниях названий (на ная или овая оканчиваются названия тех кислот, в которых элемент проявляет наивысшую валентность; на истая или овистая оканчиваются названия тех кислот, в которых элемент проявляет валентность ниже максимальной).
Примеры:HNO3 – азотная кислота, а HNO2 - азотистая кислота; H3AsO4 – мышьяковая кислота, а H3AsO3 – мышьяковистая кислота.
Одному и тому же оксиду могут соответствовать несколько кислот, при этом наиболее богатая водой форма имеет в названии приставку орто, а наименее богатая – мета (ортофосфорная кислота H3РO4 – на одну молекулу ангидрида Р2О5 приходится три молекулы воды; метафосфорная кислота HРO3 – на одну молекулу ангидрида Р2О5 приходится одна молекула воды). Следует также учитывать и то, что ряд кислот имеют исторически сложившиеся названия.
Соли являются продуктом замещения водорода в кислоте на металл или гидроксогрупп в основании на кислотный остаток. Нормальные (средние) соли получаются при полном замещении; кислые – при неполном замещении водорода кислоты на металл; основные – при неполном замещении гидроксогрупп основания на кислотный остаток. Кислая соль может быть образована только кислотой, основность которой 2 и более, а основная – металлом, заряд которого 2 и более.
Примеры:NaHS, KHCO3 – кислые соли (гидросульфид натрия и гидрокарбонат натрия); MgOHCl, CaOHCl – основные соли (хлориды гидроксо магния и кальция); NaCl, CuS – нормальные соли (хлорид натрия и сульфид меди).
| Название кислоты | Формула | Пример соли | Название соли |
| Серная | H2SO4 | K2SO4 | сульфат К |
| сернистая | H2SO3 | Na2SO3 | сульфит Na |
| соляная | HCl | Ca(Cl)2 | хлорид Са |
| иодоводородная | HI | KI | иодид К |
| сероводородная | H2S | Na2S | cульфид Na |
| азотная | HNO3 | KNO3 | нитрат К |
| азотистая | HNO2 | NaNO2 | нитрит Na |
| ортофосфорная | H3РO4 | K3РO4 | ортофосфат К |
| хлорная | НСlO4 | NaСlO4 | перхлорат Na |
| хлорноватая | НClO3 | NaСlO3 | хлорат Na |
| хлористая | НClO2 | NaСlO2 | хлорит Na |
| хлорноватистая | НСlO | NaСlO | гипохлорит Na |
| кремниевая | H2SiO3 | CaSiO3 | силикат Сa |
Продолжение табл.
| Название кислоты | Формула | Пример соли | Название соли |
| алюминиевая | H3AlO3 | K3AlO3 | алюминат К |
| ортоборная | H3BO3 | K3BO3 | ортоборат К |
| мышьяковая | H3AsO4 | K3AsO4 | арсенат К |
| мышьяковистая | H3AsO3 | K3AsO3 | арсенит К |
| двуфосфорная | H4P2O7 | K4P2O7 | дифосфат К |
| угольная | H2CO3 | K2CO3 | карбонат К |
| фосфористая | H3PO3 | K3PO3 | фосфит К |
| фтороводород | HF | KF | фторид К |
| хромовая | Н2СrO4 | K2СrO4 | хромат К |
| синильная | НCN | KCN | цианид К |
Лекция №2: Основные законы общей химии. Стехиометрия. Химический эквивалент.
1. Закон постоянства состава. Соотношение масс элементов, формирующих данное соединение, постоянно и не зависит от способа получения этого соединения.
2. Закон кратных отношений. Установлен Дальтоном в 1803г. В случае, когда два элемента образуют между собой несколько химических соединений, тогда имеет место отношение массы одного из элементов, приходящееся в этих соединениях на одну и ту же массу другого, как небольших целых чисел. Таким образом, элементы способны входить в состав соединений только в определенных пропорциях. Открытие этого закона явилось подтверждением атомной теории строения вещества. Только теперь идеи М.В. Ломоносова о строении вещества получили опытное подтверждение, и разработка атомно-молекулярного учения получила своё дальнейшее развитие.
Законы постоянства состава и кратных отношений не носят всеобщего характера, в отличии, например, от закона сохранения массы, основательность которого доказывается открытиями, сделанными после его установления. Дело в том, что после открытия изотопов получил подтверждение факт о постоянстве соотношения между массами элементов, образующих данное вещество, но только при условии постоянства изотопного состава этих элементов. Так, например, тяжелая вода содержит порядка 20% по массе водорода, тогда как обычная – только около 11%. Закон кратных отношений неприменим и в случае соединений переменного состава, открытых академиком Н.С. Курнаковым в начале ХХ века (пример: оксиды титана переменного состава TiO1,46-1,56 и TiO1,9-2,0), а также в случае, когда молекула вещества состоит из большого числа атомов (например, углеводороды состава С20Н42 и С21Н44).
3. Закон объёмных отношений. Этот закон в качестве обобщения вывел французский ученый Гей-Люссак (второе название закона – «химический»). Объёмы газов, участвующих в акте химического взаимодействия, относятся друг к другу и к объёмам образующихся газообразных продуктов реакции как небольшие целые числа. Так, например, при взаимодействии 2 объёмов водорода и 1 объёма кислорода, образуются 2 объёма водяного пара.
4. Закон Авогадро. Установлен итальянским физиком Авогадро в 1811 г. Одинаковые объемы любых газов, отобранные при одной температуре и одинаковом давлении, содержат одно и тоже число молекул. Таким образом, можно сформулировать понятие количества вещества: 1 моль вещества содержит число частиц, равное 6,02*1023 (называемое постоянной Авогадро) или содержит столько молекул, атомов, ионов, электронов или других структурных единиц, сколько содержится атомов в 12г изотопа углерода 12С. Следствием этого закона является то, что 1 моль любого газа занимает при нормальных условиях (Р0 =101,3кПа и Т0=298К) объём, равный 22,4л.
Под относительной атомной массой элемента понимают массу его атома, выраженную в атомных единицах массы (а.е.м.). В качестве относительной молекулярной массы элемента понимают массу его молекулы, выраженную в атомных единицах массы. Масса 1 моль данного вещества называется его мольной массой (выражается в г/моль). Относительной плотностью первого газа по отношению ко второму называется отношение массы первого газа к массе того же объёма второго газа, взятого при одной температуре и одинаковом давлении.
Под эквивалентом элемента понимают такое его количество, которое соединяется с 1 молем атомов водорода или замещает то же количество атомов водорода в химических реакциях. Масса 1 эквивалента элемента называется его эквивалентной массой. Эквивалент водорода ЭН всегда равен 1, а эквивалент кислорода ЭО=8.
Эквивалент элемента равен: Эм=  , где: М – мольная масса элемента; СО – степень окисления элемента (валентность) в соединении.
, где: М – мольная масса элемента; СО – степень окисления элемента (валентность) в соединении.
Эквивалент кислоты равен: Эм=  , где: М – мольная масса кислоты; х – основность кислоты.
, где: М – мольная масса кислоты; х – основность кислоты.
Эквивалент основания равен: Эм=  , где: М – мольная масса основания; у – кислотность основания.
, где: М – мольная масса основания; у – кислотность основания.
Эквивалент соли равен: Эм=  , где: М – мольная масса соли; z – валентность катиона; х – количество атомов катиона в соединении.
, где: М – мольная масса соли; z – валентность катиона; х – количество атомов катиона в соединении.
Примеры:эквивалент кислорода равен: Эо=  г-экв; эквивалент угольной кислоты Н2СО3 равен: ЭН2СО3=
г-экв; эквивалент угольной кислоты Н2СО3 равен: ЭН2СО3=  г-экв; эквивалент едкого натра NaOH равен: ЭNaOH=
г-экв; эквивалент едкого натра NaOH равен: ЭNaOH=  г-экв; эквивалент хлорида кальция CaCl2 равен: ЭCaCl2=
г-экв; эквивалент хлорида кальция CaCl2 равен: ЭCaCl2=  г-экв.
г-экв.
Закон эквивалентов. Отношение масс (или объёмов) взаимодействующих друг с другом веществ прямо пропорционально их эквивалентным массам (объёмам). Математически это можно записать следующим образом:
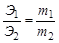 , где Э1,Э2 – эквиваленты (эквивалентные массы) элементов; m1,m2 – реальные массы (не мольные массы) веществ, например в граммах.
, где Э1,Э2 – эквиваленты (эквивалентные массы) элементов; m1,m2 – реальные массы (не мольные массы) веществ, например в граммах.
Приближенное значение мольной массы атомов элемента позволяет определить правило Дюлонга и Пти: Атомная теплоёмкость большинства простых веществ в твёрдом состоянии лежит в пределах 22-29 Дж/(моль*К) [в среднем около 26 Дж/(моль*К)]. Отсюда следует, что разделив 26 на удельную теплоёмкость простого вещества, легко определить приближённое значение мольной массы атомов соответствующего элемента.
Понятие валентности возникло в химии в середине 19 века. Д.И. Менделеев установил связь между валентностью элемента и его положением в периодической системе. Валентность элемента – это способность его атомов соединяться с другими атомами в определённых соотношениях. Способность атомов данного элемента соединяться друг с другом или с атомами других элементов может выражаться и другими способами – ковалентностью (число химических связей, образуемых атомом данного соединения) или координационным числом (число атомов, непосредственно окружающих данный атом).
Дата добавления: 2015-01-01; просмотров: 81; Мы поможем в написании вашей работы!; Нарушение авторских прав |