
КАТЕГОРИИ:
АстрономияБиологияГеографияДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРиторикаСоциологияСпортСтроительствоТехнологияФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Лекция №13: Окислительно-восстановительные реакции.
Окислительно-восстановительными называются химические реакции, сопровождающиеся изменением степени окисления атомов элементов. Степень окисления – это условный заряд атома в молекуле. Она вычисляется исходя из положения, что все связи между атомами ионные. Окислением называется процесс отдачи электронов, а восстановлением процесс принятия электронов. Окисление и восстановление взаимосвязаны. Окислителем называется вещество, атомы которого принимают электроны, при этом он восстанавливается. Восстановителем называется вещество, атомы которого отдают электроны, при этом он окисляется.
Все окислительно-восстановительные реакции классифицируют следующим образом:
1. Межмолекулярные реакции. Это реакции, в которых окислитель и восстановитель являются различными веществами.
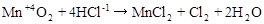 ,
,
где Mn+4 – окислитель, Cl-1 – восстановитель.
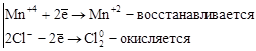
2. Реакции внутримолекулярного окисления. Это реакции, которые протекают с изменением степеней окисления атомов различных элементов одного и того же вещества.
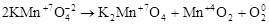 ,
,
где Mn+7 – окислитель, а O-2 – восстановитель.
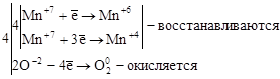
3. Реакции диспропорционирования. В этих реакциях и окислителем и восстановителем является элемент, находящийся в промежуточной степени окисления в составе одного и того же вещества.
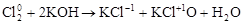 ,
,
где Cl20 – окислитель и восстановитель.
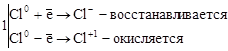
О возможности того или иного вещества проявлять окислительные, восстановительные или двойственные свойства можно судить по степени окисления элементов, выполняющих эти функции.
Элементы в своей высшей степени окисления проявляют только окислительные свойства, а в низшей степени окисления проявляют только восстановительные свойства. Элементы, имеющие промежуточную степень окисления, могут проявлять как окислительные, так и восстановительные свойства. Основные окислители и восстановители приведены ниже.
| Окислители | Схемы реакций | |||
| Простые вещества: Галогены Г2 |  (НГ и их соли) (НГ и их соли)
| |||
| Кислород О2 | 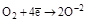 (H2O, оксиды и их производные) (H2O, оксиды и их производные)
| |||
| Неметаллы (S,P,N2) | 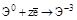 (ЭНn и их соли) (ЭНn и их соли)
| |||
| Сложные вещества: HCl, H2SO4 (разбавленные) и т. п. (кроме НNO3). | 
| |||
| H2SO4 конц. | 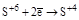 (SO2, H2SO3 и её соли) (SO2, H2SO3 и её соли)
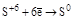 (S¯) (S¯)
 (H2S и её соли) (H2S и её соли)
| |||
| HNO3 конц. HNO3 разб. | 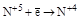 (NO2) (NO2)
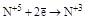 (N2O3, HNO2 и её соли) (N2O3, HNO2 и её соли)
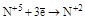 (NO) (NO)
 (N2O) (N2O)
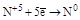 (N2) (N2)
 (NH3, NH4+ и соответствующие соли) (NH3, NH4+ и соответствующие соли)
| |||
| Окислители | Схемы реакций | |||
| KMnO4 |  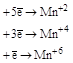 
| |||
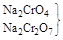
| 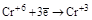 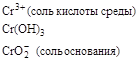
| |||
| H2O2 | 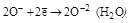
| |||
| Катионы металлов высшей степени окисления (Fe+3, Sn+4, и т. п.) | 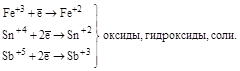
| |||
| Восстановители | Схемы реакций | |||
| Простые вещества: металлы (Ме) | 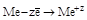
| |||
| Н2 | 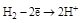 (H2O) (H2O)
| |||
| Неметаллы (S,C,P,N2,…) | 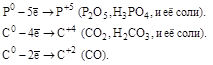
| |||
| H2S и её соли, Na2S2O3 | 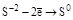
| |||
| НГ и их соли | 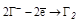
| |||
| Катионы металлов в низших степенях окисления (Fe+2, Sn+2, Sb+3, Cr+3 и т.д.) | 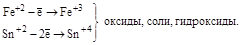 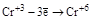 
| |||
| HNO2 и её соли. |  (HNO3 или ее соли). (HNO3 или ее соли).
| |||
| H2SO3 и её соли. | 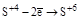 (H2SO4 или ее соли). (H2SO4 или ее соли).
| |||
| H2O2 | 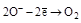
| |||
Дата добавления: 2015-01-01; просмотров: 78; Мы поможем в написании вашей работы!; Нарушение авторских прав |