
КАТЕГОРИИ:
АстрономияБиологияГеографияДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРиторикаСоциологияСпортСтроительствоТехнологияФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
ГОМОГЕННЫЕ РЕАКЦИИ
ГОМОГЕ́ННЫЕ РЕА́КЦИИ (от греч. «homogenes» — однородный), химические реакции между веществами, находящимися в одной фазе. Параметры гомогенных реакций имеют одинаковые значения или изменяются непрерывно. Их скорость определяется изменением концентрации одного из веществ в единицу времени и подчиняется закону действующих масс (см. ДЕЙСТВУЮЩИХ МАСС ЗАКОН). Примером гомогенных реакций является термическое разложение оксида азота: 2N2O5 ® 4NO2 + O2. Гетерогенные реакции, хим. реакции с участием веществ, находящихся в различных фазах и составляющих в совокупности гетерогенную систему. Типичные гетерогенные реакции: термическое разложение солей с образованием газообразных и твердых продуктов (например, СаСО3 -> СаО + СО2), восстановление оксидов металлов водородом илиуглеродом
(например, РbО + С -> Рb + СО), растворение металлов в кислотах (например, Zn + H2SO4 -> ZnSO4 + Н2), взаимодействие твердых реагентов (Аl2О3 + NiO -> NiAl2O4). В особый класс выделяют гетерогенно-каталитические реакции, протекающие на поверхности катализатора, при этом реагенты и продукты могут и не находиться в разных фазах. Например, при реакции N2 + + ЗН2 -> 2NH3, протекающей на поверхности железного катализатора, реагенты и продукт реакции находятся в газовой фазе и образуют гомогенную систему. Скорость химической реакции — изменение количества одного из реагирующих веществ за единицу времени в единице реакционного пространства. Является ключевым понятиемхимической кинетики. Скорость химической реакции — величина всегда положительная, поэтому, если она определяется по исходному веществу (концентрация которого убывает в процессе реакции), то полученное значение умножается на −1. Например для реакции: выражение для скорости будет выглядеть так:
выражение для скорости будет выглядеть так:  Зако́н де́йствующих масс устанавливает соотношение между массами реагирующих веществ в химических реакциях при равновесии, а также зависимость скорости химической реакции от концентрации исходных веществ. Закон действующих масс в кинетической форме (основное уравнение кинетики) гласит, что скорость элементарной химической реакции пропорциональна произведению концентрацийреагентов в степенях, равных стехиометрическим коэффициентам в уравнении реакции[1]. Это положение сформулировано в 1867 году норвежскими учёными К. Гульдбергом и П. Вааге. Для элементарной химической реакции:
Зако́н де́йствующих масс устанавливает соотношение между массами реагирующих веществ в химических реакциях при равновесии, а также зависимость скорости химической реакции от концентрации исходных веществ. Закон действующих масс в кинетической форме (основное уравнение кинетики) гласит, что скорость элементарной химической реакции пропорциональна произведению концентрацийреагентов в степенях, равных стехиометрическим коэффициентам в уравнении реакции[1]. Это положение сформулировано в 1867 году норвежскими учёными К. Гульдбергом и П. Вааге. Для элементарной химической реакции: 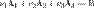 закон действующих масс может быть записан в виде кинетического уравнения вида:
закон действующих масс может быть записан в виде кинетического уравнения вида:  где
где  — скорость химической реакции,
— скорость химической реакции,  — константа скорости реакции. Для сложных реакций в общем виде это соотношение не выполняется. Тем не менее, многие сложные реакции условно можно рассматривать как ряд последовательных элементарных стадий с неустойчивыми промежуточными продуктами, формально эквивалентный переходу из начального состояния в конечное в «один шаг». Такие реакции называют формально простыми[2]. Для формально простых реакций кинетическое уравнение может быть получено в виде:
— константа скорости реакции. Для сложных реакций в общем виде это соотношение не выполняется. Тем не менее, многие сложные реакции условно можно рассматривать как ряд последовательных элементарных стадий с неустойчивыми промежуточными продуктами, формально эквивалентный переходу из начального состояния в конечное в «один шаг». Такие реакции называют формально простыми[2]. Для формально простых реакций кинетическое уравнение может быть получено в виде:  (для трех исходных веществ, аналогично приведённому выше уравнению). Здесь
(для трех исходных веществ, аналогично приведённому выше уравнению). Здесь  ,
,  ,
,  — порядок реакции по веществам
— порядок реакции по веществам  ,
,  ,
,  соответственно, а сумма
соответственно, а сумма 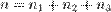 — общий (или суммарный) порядок реакции.
— общий (или суммарный) порядок реакции.  ,
,  ,
,  могут быть не равны стехиометрическим коэффициентам и не обязательно целочисленные.
могут быть не равны стехиометрическим коэффициентам и не обязательно целочисленные.  при определённых условиях может быть равно и нулю.
при определённых условиях может быть равно и нулю. Правило Вант-Гоффа — эмпирическое правило, позволяющее в первом приближении оценить влияние температуры на скорость химической реакции в небольшом температурном интервале (обычно от 0 °C до 100 °C). Я. Х. Вант-Гофф на основании множества экспериментов сформулировал следующее правило:
| При повышении температуры на каждые 10 градусов константа скорости гомогенной элементарной реакции увеличивается в два — четыре раза. |
Уравнение, которое описывает это правило следующее:
 где
где  — скорость реакции при температуре
— скорость реакции при температуре  ,
,  — скорость реакции при температуре
— скорость реакции при температуре  ,
,  — температурный коэффициент реакции (если он равен 2, например, то скорость реакции будет увеличиваться в 2 раза при повышении температуры на 10 градусов). Следует помнить, что правило Вант-Гоффа применимо только для реакций с энергией активации 60-120 кДж/моль в температурном диапазоне 10-400oC. Правилу Вант-Гоффа также не подчиняются реакции, в которых принимают участие громоздкие молекулы, например белки в биологических системах. Температурную зависимость скорости реакции более корректно описывает уравнение Аррениуса. Из уравнения Вант-Гоффа температурный коэффициент вычисляется по формуле:
— температурный коэффициент реакции (если он равен 2, например, то скорость реакции будет увеличиваться в 2 раза при повышении температуры на 10 градусов). Следует помнить, что правило Вант-Гоффа применимо только для реакций с энергией активации 60-120 кДж/моль в температурном диапазоне 10-400oC. Правилу Вант-Гоффа также не подчиняются реакции, в которых принимают участие громоздкие молекулы, например белки в биологических системах. Температурную зависимость скорости реакции более корректно описывает уравнение Аррениуса. Из уравнения Вант-Гоффа температурный коэффициент вычисляется по формуле: 
19) Необратимые реакции — реакции, при которых взятые вещества нацело превращаются в продукты реакции, не реагирующие между собой при данных условиях, например, разложение взрывчатых веществ, горение углеводородов, образование малодиссоциирующих соединений, выпадение осадка, образование газообразных веществ. Ba(ClO2)2 + H2SO4 → 2HClO2 + BaSO4↓ NaHCO3 + CH3COOH → CH3COONa + H2O + CO2↑ Однако надо понимать, что при изменении условий протекания реакции, теоретически возможно сместить равновесие любой реакции. Обратимые реакции — химические реакции, протекающие одновременно в двух противоположных направлениях (прямом и обратном), например: 3H2 + N2 ⇌ 2NH3. Направление обратимых реакций зависит от концентраций веществ — участников реакции. Так в приведённой реакции, при малой концентрации аммиака в газовой смеси и больших концентрациях азота и водорода происходит образование аммиака; напротив, при большой концентрации аммиака он разлагается, реакция идёт в обратном направлении. По завершении обратимой реакции, т. е. при достижении химического равновесия, система содержит как исходные вещества, так и продукты реакции Простая (одностадийная) обратимая реакция состоит из двух происходящих одновременно элементарных реакций, которые отличаются одна от другой лишь направлением химического превращения. Направление доступной непосредственному наблюдению итоговой реакции определяется тем, какая из этих взаимно-обратных реакций имеет большую скорость. Например, простая реакци я N2O4 ⇌ 2NO2 складывается из элементарных реакций N2O4 ⇌ 2NO2 и 2NO2 ⇌ N2O4. Химическое равновесие — состояние химической системы, в котором обратимо протекает одна или несколько химических реакций, причём скорости в каждой паре прямая-обратная реакция равны между собой. Для системы, находящейся в химическом равновесии, концентрации реагентов, температура и другие параметры системы не изменяются со временем.[1] А2 + В2 ⇄ 2AB Конста́нта равнове́сия — величина, определяющая для данной химической реакции соотношение между термодинамическими активностями (либо, в зависимости от условий протекания реакции, парциальными давлениями, концентрациями или фугитивностями) исходных веществ и продуктов в состоянии химического равновесия (в соответствии с законом действующих масс). Зная константу равновесия реакции, можно рассчитать равновесный состав реагирующей смеси, предельный выход продуктов, определить направление протекания реакции. Смещение химического равновесия Основная статья: Принцип Ле Шателье — Брауна Положение химического равновесия зависит от следующих параметров реакции: температуры, давления и концентрации. Влияние, которое оказывают эти факторы на химическую реакцию, подчиняются закономерности, которая была высказана в общем виде в 1885 году французским ученым Ле-Шателье
. Факторы, влияющие на химическое равновесие: 1) температура При увеличении температуры химическое равновесие смещается в сторону эндотермической (поглощение) реакции, а при понижении в сторону экзотермической (выделение) реакции CaCO3=CaO+CO2 -Q t↑ →, t↓ ← N2+3H2↔2NH3 +Q t↑ ←, t↓ → 2) давление При увеличении давления химическое равновесие смещается в сторону меньшего объёма веществ, а при понижении в сторону большего объёма. Этот принцип действует только на газы, т.е. если в реакции участвуют твердые вещества, то они в расчет не берутся. CaCO3=CaO+CO2 P↑ ←, P↓ → 1моль=1моль+1моль 3) концентрация исходных веществ и продуктов реакции При увеличении концентрации одного из исходных веществ химическое равновесие смещается в сторону продуктов реакции, а при повышении концентрации продуктов реакции-в сторону исходных веществ. S2+2O2=2SO2 [S],[O]↑ →, [SO2]↑ ← Катализаторы не влияют на смещение химического равновесия!20 Растворы. Способы выражения концентрации растворов. Раствор – гомогенная система, образованная двумя или более веществами, которые, как правило, подразделяют на растворитель и растворённые вещества.
«Гомогенный» - значит, каждый из компонентов распределён в массе другого в виде своих частиц, то есть атомов, молекул или ионов
Растворитель - компонент, агрегатное состояние которого не изменяется при образовании раствора. В случае же растворов, образующихся при смешении газа с газом, жидкости с жидкостью, твёрдого вещества с твёрдым, растворителем считается компонент, количество которого в растворе преобладает.
Если вода является одним из веществ раствора, то, как правило, её считают растворителем.
Раствор, находящийся при данных условиях в равновесии с растворяемым веществом, называется насыщенным раствором.
Раствор, в котором при данных условиях предел растворимости не достигнут, называется ненасыщенным.
Важной характеристикой раствора является относительное содержание а нём растворенного вещества и растворителя, которое называется концентрацией.
Качественно растворы делятся на разбавленные, в которых растворённого вещества мало, и концентрированные. в которых растворённого вещества много.
Способы выражения концентраций растворов:
Мольная (молярная) доля вещества — концентрация, выраженная отношением числа молей вещества к общему числу молей всех веществ, имеющихся в растворе.Моляльность — количество растворённого вещества (число моль) в 1000 г растворителя. Измеряется в молях на кг, также распространено выражение в «моляльности». Так, раствор с концентрацией 0,5 моль/кг называют 0,5-мольным. m=v/m2 ν — количество растворённого вещества, моль;
m2 — масса растворителя, кг.
Следует обратить особое внимание, что несмотря на сходство названий, молярная концентрация и моляльность — величины различные. Прежде всего, в отличие от молярной концентрации, при выражении концентрации в моляльности расчёт ведут на массу растворителя, а не на объём раствора. Моляльность, в отличие от молярной концентрации, не зависит от температуры.
Массовая доля (С) – процентное содержание массы растворённого вещества к общей массе раствора. Мольная доля (Ni) — отношение количества молей данного компонента к общему количеству молей всех компонентов. Мольную долю выражают в долях единицы. Например, в системе, состоящей из растворителя и единственного растворённого вещества, мольная доля последнего (N2) равна N2=n2/(n1+n2), а мольная доля растворителя (N1) равна N1=n1/(n1+n2), где n1 и n2 – соответственно количество вещества растворителя и количество растворённого вещества
Молярная концентрация эквивалента или нормальность (Cн или н.) - отношение числа эквивалентов растворённого вещества к объёму раствора, выраженному в литрах. *Молярная концентрация, или молярность (См или M) – отношение числа молей растворённого вещества (количества растворённого вещества) к объёму раствора, выраженному в литрах.
Меняется в зависимости от температуры.
21 Электролитическая диссоциация. Степень диссоциации. Константа электролитической диссоциации ЭЛЕКТРОЛИТИЧЕСКАЯ ДИССОЦИАЦИЯ, полный или частичный распад молекул растворенного в-ва на катионы и анионы. Электролитической диссоциацией называют также распад на катионы и анионы ионных кристаллов при растворении или расплавлении. Электролитическая диссоциация, как правило, происходит в полярных р-рителях. При электролитической диссоциации разрываются обычно лишь наиб. полярные связи молекул. Электролитической диссоциацией могут подвергаться молекулы нек-рых р-рителей, напр. воды.
Осн. причинами электролитической диссоциации являются, с одной стороны, взаимод. растворенного в-ва с р-рителем, к-рое приводит ксольватации ионов, а с другой стороны - значит. ослабление электро-статич. взаимод. между сольватир. ионами в среде, обусловленное ее электростатич. полем (диэлектрич. проницаемостью р-рителя). При этом работа, необходимая для разрушения молекул (кристаллич. решетки), обеспечивается за счет энергии сольватации.
Электролитическая диссоциация лежит в основе деления р-ров на два класса - растворы неэлектролитов и растворы электролитов. Степень диссоциации — величина, характеризующая состояние равновесия в реакции диссоциации в гомогенных (однородных) системах. "Степень диссоциации это есть отношения числа продиссоциируемых молекул к общему числу молекул и умноженному на 100%":  числа распавшихся на ионы молекул к общему числу растворенных молекул. Степень диссоциации
числа распавшихся на ионы молекул к общему числу растворенных молекул. Степень диссоциации  равна отношению числа диссоциированных молекул
равна отношению числа диссоциированных молекул  к сумме
к сумме  , где
, где  — число недиссоциированных молекул. Часто
— число недиссоциированных молекул. Часто  выражают в процентах. Степень диссоциации зависит как от природы растворённого электролита, так и от концентрации раствора.
выражают в процентах. Степень диссоциации зависит как от природы растворённого электролита, так и от концентрации раствора.
Константа диссоциации — вид константы равновесия, которая характеризует склонность объекта диссоциировать (разделяться) обратимым образом на частицы, как например когда комплекс распадается на составляющие молекулы, или когда соль диссоциирует в водном растворе на ионы. Константа диссоциации обычно обозначается Kd и обратно константе ассоциации. В случае с солями, константу диссоциации иногда называют константой ионизации.
В общей реакции 
где комплекс  разбивается на x единиц A и y единиц B, константа диссоциации определяется так:
разбивается на x единиц A и y единиц B, константа диссоциации определяется так:  где [A], [B] и [AxBy] — концентрации A, B и комплекса AxBy соответственно.
где [A], [B] и [AxBy] — концентрации A, B и комплекса AxBy соответственно.
Константа электролитической диссоциации зависит от 1)природы электролита, 2)природы растворителя, 3)температуры, НО она не зависит от концентрации электролита.
Закон разбавления Оствальда — соотношение, выражающее зависимость эквивалентной электропроводности разбавленного раствора бинарного слабого электролита от концентрации раствора: K=cλ2/λ∞(λ∞-λ)
Здесь К — константа диссоциации электролита, с — концентрация, λ и λ∞ — значения эквивалентной электропроводности соответственно при концентрации с и при бесконечном разбавлении. Соотношение является следствием закона действующих масс и равенства
λ / λ∞ = α где α — степень диссоциации.
22 Электролитическая диссоциация воды. Водородный показатель pH. Гидролиз солей. Диссоциация воды – процесс эндотермический, поэтому с повышением температуры в соответствии с принципом Ле-Шателье диссоциация усиливается, ионное произведение возрастает и достигает при 100оС значения 10-13. В чистой воде при 25оС концентрации ионов водорода и гидроксила равны между собой: Чистая вода, хоть и плохо (по сравнению с растворами электролитов), но может проводить электрический ток. Это вызвано способностью молекулы воды распадаться (диссоциировать) на два иона которые и являются проводниками электрического тока в чистой воде (ниже под диссоциацией подразумевается электролитическая диссоциация - распад на ионы): H2O ↔ H+ + OH- Примерно на 556 000 000 не диссоциированных молекул воды диссоциирует только 1 молекула, однако это 60 000 000 000 диссоциированных молекул в 1мм3. Диссоциация обратима, то есть ионы H+ и OH- могут снова образовать молекулу воды. В итоге наступает динамическое равновесие при котором количество распавшихся молекул равно количеству образовавшихся из H+ и OH- ионов. Другими словами скорости обоих процессов будут равны. Для нашего случая, уравнение скорости химической реакции можно написать так: υ1 = κ1 • [H2O] (для диссоциации воды) υ2 = κ2 • [H+] • [HO-] (для обратного процесса) где υ - скорость реакции; κ - константа скорости реакции (зависящая от природы реагирующих веществ и температуры); [H2O], [H+] и [HO-] - концентрации (моль/л). Водородный показатель (рН) Водородный показатель характеризует концентрацию свободных ионов водорода в воде. Для удобства отображения был введен специальный показатель, названный рН и представляющий собой логарифм концентрации ионов водорода, взятый с обратным знаком, т.е. pH = -log[H+]. Если говорить проще, то величина рН определяется количественным соотношением в воде ионов Н+ и ОН-, образующихся при диссоциации воды. Если в воде пониженное содержание свободных ионов водорода (рН>7) по сравнению с ионами ОН-, то вода будет иметь щелочную реакцию, а при повышенном содержании ионов Н+ (рН<7)- кислую. В идеально чистой дистиллированной воде эти ионы будут уравновешивать друг друга. В таких случаях вода нейтральна и рН=7. Главное заключается в том, что рН - это показатель интенсивности, но не количества. То есть, рН отражает степень кислотности или щелочности среды, в то время как кислотность и щелочность характеризуют количественное содержание в воде веществ, способных нейтрализовывать соответственно щелочи и кислоты. В качестве аналогии можно привести пример с температурой, которая характеризует степень нагрева вещества, но не количество тепла. Например, опустив руку в воду, мы можем сказать какая вода - прохладная или теплая, но при этом не сможем определить сколько в ней тепла (т.е. условно говоря, как долго эта вода будет остывать). В зависимости от уровня рН воды можно условно разделить на несколько групп:
| Величина рН | |
| сильнокислые воды | < 3 |
| кислые воды | 3 - 5 |
| слабокислые воды | 5 - 6.5 |
| нейтральные воды | 6.5 - 7.5 |
| слабощелочные воды | 7.5 - 8.5 |
| щелочные воды | 8.5 - 9.5 |
| сильнощелочные воды | > 9.5 |
pH воды - один из важнейших рабочих показателей качества воды, во многом определяющих характер химических и биологических процессов, происходящих в воде. В зависимости от величины pH может изменяться скорость протекания химических реакций, степень коррозионной агрессивности воды, токсичность загрязняющих веществ и т.д. Гидролиз солей — разновидность реакций гидролиза, обусловленного протеканием реакций ионного обмена в растворах (преимущественно, водных) растворимых солей-электролитов. Движущей силой процесса является взаимодействие ионов с водой, приводящее к образованию слабого электролита в ионном или (реже) молекулярном виде («связывание ионов»). Различают обратимый и необратимый гидролиз солей: 1. Гидролиз соли слабой кислоты и сильного основания (гидролиз по аниону): 
 (раствор имеет слабощелочную среду, реакция протекает обратимо, гидролиз по второй ступени протекает в ничтожной степени) 2. Гидролиз соли сильной кислоты и слабого основания (гидролиз по катиону):
(раствор имеет слабощелочную среду, реакция протекает обратимо, гидролиз по второй ступени протекает в ничтожной степени) 2. Гидролиз соли сильной кислоты и слабого основания (гидролиз по катиону): 
 (раствор имеет слабокислую среду, реакция протекает обратимо, гидролиз по второй ступени протекает в ничтожной степени) 3. Гидролиз соли слабой кислоты и слабого основания:
(раствор имеет слабокислую среду, реакция протекает обратимо, гидролиз по второй ступени протекает в ничтожной степени) 3. Гидролиз соли слабой кислоты и слабого основания: 
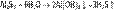 (равновесие смещено в сторону продуктов, гидролиз протекает практически полностью, так как оба продукта реакции уходят из зоны реакции в виде осадка или газа). Соль сильной кислоты и сильного основания не подвергается гидролизу, и раствор нейтрален.
(равновесие смещено в сторону продуктов, гидролиз протекает практически полностью, так как оба продукта реакции уходят из зоны реакции в виде осадка или газа). Соль сильной кислоты и сильного основания не подвергается гидролизу, и раствор нейтрален.
Дата добавления: 2015-01-01; просмотров: 397; Мы поможем в написании вашей работы!; Нарушение авторских прав |