
КАТЕГОРИИ:
АстрономияБиологияГеографияДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРиторикаСоциологияСпортСтроительствоТехнологияФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Химический эквивалент
Химический эквивалент элемента (Э)- такое его количество, которое соединяется с одним молем атомов водорода или замещает его в реакциях. Массу 1 эквивалента называют эквивалентной массой. Эквивалент выражают в молях, эквивалентную массу – в г/моль.
Число z, показывающее сколько химических эквивалентов содержится в структурной единице называется эквивалентным числом. Обратная ему величина является фактором эквивалентностиfЭ(Х): fЭ(Х) = 1 / z
Фактор эквивалентности fЭ(Х) – число, обозначающее какая доля реальной частицы вещества (Х)эквивалентна одному иону водорода в данной кислотно-основной реакции или одному электрону в данной окислительно-восстановительной реакции.
Химический эквивалент (Э) соединения можно определить по формуле:
Э = Мr × fЭ(Х),
где Мr – относительная молекулярная массасоединения;
fЭ(Х) = 1 / z– фактор эквивалентности соединения.
Для соединений: fЭ(кислот) =  ;
;
fЭ(оснований) = 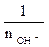 ;
;
fЭ(солей) =  ;
;
Молярная масса эквивалента вещества Х– (МЭ(Х)) – масса одного моля эквивалента этого вещества. Она равна произведению фактора эквивалентности на молярную массу вещества (Х):
МЭ(Х) = fЭ(Х) × M(Х) .
Дата добавления: 2015-01-01; просмотров: 150; Мы поможем в написании вашей работы!; Нарушение авторских прав |