
КАТЕГОРИИ:
АстрономияБиологияГеографияДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРиторикаСоциологияСпортСтроительствоТехнологияФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Циклічні амінокислоти
Ациклічні амінокислоти
Аліфатичні незаміщені амінокислоти (моноаміно-монокарбонові) – гліцин, аланін, валін, лейцин, ізолейцин.
Аліфатичні заміщені амінокислоти
· Гідроксіамінокислоти (серин, треонін).
· Сірковмісні (метіонін, цистеїн).
· Карбоксіамінокислоти (моноамінодикарбонові кислоти) – аспарагінова кислота, глутамінова кислота.
· Аміди дикарбонових кислот (аспарагін, глутамін).
· Диамінокислоти (диаміномонокарбонові кислоти) – лізин, аргінін.
Циклічні амінокислоти
Ароматичні амінокислоти (фенілаланін, тирозин).
Гетероциклічні амінокислоти (триптофан, гістидин).
Циклічна імінокислота (пролін).
II За полярністю радикалів, тобто здатністю амінокислот до взаємодії із водою при фізіологічних значеннях pН (близько pН 7,0):
1. Неполярні (гідрофобні) (аланін, валін, лейцин, ізолейцин, пролін, фенілаланін, триптофан, метіонін).
2. Полярні незаряджені(гліцин, серин, треонін, тирозин, цистеїн, аспарагін, глутамін).
3. Полярні негативно заряджені (глутамінова кислота, аспарагінова кислота).
4. Полярні позитивно заряджені (лізин, аргінін, гістидин).
IV Біологічна (фізіологічна) – за мірою незамінності амінокислот для організму:
1. Замінні амінокислоти. Серед 20 протеїногенних амінокислот 8 амінокислот в організмі людини у достатній кількості синтезуються de novo з інших інтермедіатів (аланін, аспарагінова кислота, аспарагін, глутамінова кислота, глутамін, пролін, гліцин, серин).
2. Незамінні (есенціальні) амінокислоти– не синтезуються ферментними системами організму людини, тому повинні обов’язково надходити із харчовими продуктами (валін, лейцин, ізолейцин, фенілаланін, триптофан, метіонін, треонін, лізин).
3. Частково замінні амінокислоти – синтезуються в організмі у недостатній кількості (аргінін, гістидин).
4. Умовно замінні амінокислоти – синтезуються в організмі із незамінних амінокислот: цистеїн (синтезується із незамінної амінокислоти метіоніну), тирозин (синтезується із незамінної амінокислоти фенілаланіну).
 | |||||||||
 | |||||||||
 | |||||||||
 | |||||||||
 | |||||||||
 | |||||||||
 |
 | |||
 |
Кислотно-основнi властивостi амiнокислот. Здатнiсть рухатися до аноду або катоду в залежностi вiд рН розчину. Iзоiонна точка. Кривi титрування. Типова крива тiтрування амінокислот.
Аінокислоти є амфотерними сполуками або амфолітами (від «амфотерний електроліт»). Вони можуть виступати як кислотами, так і основами завдяки наявності карбоксильної і аміногрупи відповідно. Якщо амінокислоту із бічним ланцюгом не здатним до іонізації розчинити у воді при pH 7,0 вона перебуватиме у формі цвітеріона тобто нестиме одночасно позитивний і негативний заряди.
Криві титрування амінокислот
Крива титрування 0,1 М розчину гліцину при 25 °C гідроксидом натрію. Один еквівалент [OH-] = 0,1 моль NaOH.
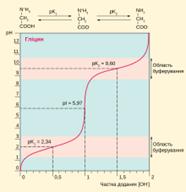
Кожна амінокислота має принаймні дві групи здатні до іонізації: α-аміно- та α-карбоксильну. Через це крива титрування повністю протонованої форми амінокислоти сильною основою має дві фази, кожна із яких відповідає депротонуванню однієї із груп. Як приклад наведено титрування 0,1 М розчину гліцину при температурі 25 °C (рисунок зліва). У дуже кислотному середовищі молекули гліцину повністю протоновані (NH+3-CH2-COOH), при
підвищенні pH карбоксильна група починає іонізуватись, і за значення водневого показника, що дорівнює pKa цієї групи (pK1) у розчині наявні еквімолярні концентрації NH+3-CH2-COOH і NH+3-CH2-COO+. У діапазоні pH pK1±1 гліцин проявляє буферні властивості.
Подальше зростання pH призводить до повної дисоціації протонів від карбоксильних груп. У той момент, коли депротонування карбоксильних груп вже майже завершилось, а депротонування аміногруп ще не розпочалось, молекули амінокислоти перебувають у цвітеріонній формі (NH+3-CH2-COO+). Це значення pH, за якого сумарний заряд максимальної кількості молекул амінокислоти у розчині рівний нулю, називається ізоелектричною точкою і позначається pI. У діапазоні pH вище pI відбувається друга фаза титрування амінокислоти: поступове депротонування аміногруп. При pH = pK2 у розчині будуть еквімолярні концентрації NH+3-CH2-COO+ і NH2-CH2-COO+. У ділянці pK2±1 амінокислота також проявлятиме буферні властивості.
Важливою особливістю амінокислот є те, що їхні карбоксильні групи є «більш кислотними», а аміногрупи «менш основними», ніж ці ж групи в складі сполук, в яких вони приєднані до аліфатичних вуглеводневих залишків/Обидві групи легше віддають протони внаслідок їх взаємного впливу одна на одну.
Ізоелектрична точка
Для амінокислот, що не містять груп здатних до іонізації у бічних ланцюгах, ізоелектричну точку можна розрахувати як середнє арифметичне між константами кислотної дисоціації карбоксильної та аміногруп:
При pH вище цієї точки більшість молекул амінокислоти в розчині матимуть негативний заряд і в електричному полі рухатимуться до анода, при нижчому — позитивний і рухатимуться до катода. Амінокислоти із незарядженими бічними ланцюгами мають приблизно однакові значення pI близькі до 6,0. Незначна різниця цих показників відображає вплив бічних груп на здатністю карбоксильної та аміногрупи до іонізації.
Дата добавления: 2015-01-19; просмотров: 466; Мы поможем в написании вашей работы!; Нарушение авторских прав |