
КАТЕГОРИИ:
АстрономияБиологияГеографияДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРиторикаСоциологияСпортСтроительствоТехнологияФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Компонентов
Под теоретическим соотношением компонентов (стехиометрическим коэффициентом)  понимают минимальное количество килограммов окислителя, которое приходится на один килограмм горючего при полном окислении горючих элементов топлива. При этом считают, что азот в реакциях окисления не участвует.
понимают минимальное количество килограммов окислителя, которое приходится на один килограмм горючего при полном окислении горючих элементов топлива. При этом считают, что азот в реакциях окисления не участвует.
Полным является такое окисление, когда углерод  окисляется до
окисляется до  , водород
, водород  – до
– до  и т.д., т.е. в реакциях окисления проявляются высшие валентности элементов.
и т.д., т.е. в реакциях окисления проявляются высшие валентности элементов.
Поскольку в действительности наряду с продуктами полного окисления имеются продукты неполного окисления (например, 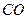 ,
,  и др.), а также
и др.), а также 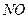 (т.е. азот частично окисляется), то
(т.е. азот частично окисляется), то  носит условный характер. Стехиометрический коэффициент
носит условный характер. Стехиометрический коэффициент  служит ориентиром для того, чтобы назначить действительное соотношение компонентов
служит ориентиром для того, чтобы назначить действительное соотношение компонентов  . Значение
. Значение  может быть определено по формуле замещения валентности элементов:
может быть определено по формуле замещения валентности элементов:
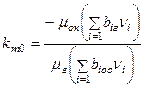 , (6)
, (6)
где  – валентность (с учетом знака);
– валентность (с учетом знака);  – число грамм-атомов i-го элемента в условных формулах окислителя и горючего.
– число грамм-атомов i-го элемента в условных формулах окислителя и горючего.
Напомним, что наивысшие валентности равны: у водорода  , у углерода
, у углерода  , у кислорода
, у кислорода  . В ряде случаев вводится мольное соотношение компонентов
. В ряде случаев вводится мольное соотношение компонентов  , т.е. количество молей окислителя, потребное для полного окисления одного моля горючего. При расчете
, т.е. количество молей окислителя, потребное для полного окисления одного моля горючего. При расчете  молекулярные массы горючего
молекулярные массы горючего  и окислителя
и окислителя  могут быть найдены из химической или условной формул компонентов.
могут быть найдены из химической или условной формул компонентов.
Действительное соотношение между компонентами топлива можно характеризовать коэффициентом избытка окислителя:
 . (7)
. (7)
При  топливо содержит избыток окислителя, а при
топливо содержит избыток окислителя, а при  – избыток горючего. Подставляя в (7) выражение для
– избыток горючего. Подставляя в (7) выражение для  , можно определить секундный расход каждого из компонентов:
, можно определить секундный расход каждого из компонентов:  , откуда
, откуда
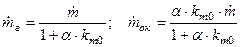 .
.
На основании (8) можно записать условную формулу двухкомпонентного топлива в следующем виде:
 , (8)
, (8)
где число грамм-атомов элементов в условном моле топлива определяется соотношениями:
 ;
;
 ;
;
 .
.
Здесь 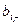 и
и 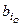 – соответственно число грамм-атомов i-го элемента в молях горючего и окислителя. Заметим, что в общем случае в этих расчетах могут использоваться условные формулы компонентов.
– соответственно число грамм-атомов i-го элемента в молях горючего и окислителя. Заметим, что в общем случае в этих расчетах могут использоваться условные формулы компонентов.
Пример: Для топлива, в котором в качестве горючего использован диметилгидразин  (
(  ), а в качестве окислителя – четырехокись азота
), а в качестве окислителя – четырехокись азота 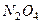 , имеющая влажность 4%, определить значение
, имеющая влажность 4%, определить значение  и записать условную формулу при
и записать условную формулу при  .
.
Как было показано ранее, условная формула данного окислителя имеет вид  (
(  ). Стехиометрическое соотношение:
). Стехиометрическое соотношение:

Мольное стехиометрическое соотношение

Действительное мольное соотношение:

Следовательно, условную формулу данного топлива на основании (8) можно записать в виде:
 ,
,
где  ;
;
 ;
;
 ;
;
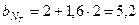 .
.
Дата добавления: 2015-01-19; просмотров: 86; Мы поможем в написании вашей работы!; Нарушение авторских прав |