
КАТЕГОРИИ:
АстрономияБиологияГеографияДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРиторикаСоциологияСпортСтроительствоТехнологияФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Энтальпия
Уравнением (2) для ПС была введена полная энтальпия, которая учитывает химическую энергию веществ. Она характеризует все запасы энергии вещества, кроме кинетической:
 ,
,
где  – начальная температура отсчета. Поскольку в термодинамических расчетах постоянно имеют дело с разностями или суммами полных энтальпий, то значение
– начальная температура отсчета. Поскольку в термодинамических расчетах постоянно имеют дело с разностями или суммами полных энтальпий, то значение  можно выбирать произвольно. При расчете понятие полной энтальпии вводится также для топлива и его компонентов. Это позволяет записать баланс энергии в двигателе через полную энтальпию.
можно выбирать произвольно. При расчете понятие полной энтальпии вводится также для топлива и его компонентов. Это позволяет записать баланс энергии в двигателе через полную энтальпию.
В существующих системах отсчета в качестве  выбирают температуры 298,15 К; 293,15 К; и 0 К. Под химической энергией понимают то количество тепла, которое выделяется или поглощается при образовании данного вещества из некоторых исходных веществ, так называемых стандартных элементов, химическая энергия которых берется за нуль отсчета. В качестве нулей отсчета химической энергии обычно берут газообразные
выбирают температуры 298,15 К; 293,15 К; и 0 К. Под химической энергией понимают то количество тепла, которое выделяется или поглощается при образовании данного вещества из некоторых исходных веществ, так называемых стандартных элементов, химическая энергия которых берется за нуль отсчета. В качестве нулей отсчета химической энергии обычно берут газообразные 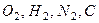 (графит β- модификации, электронный газ и т.д. Указанные состояния исходных веществ (они называются стандартными состояниями) являются наиболее устойчивыми и распространенными в природных условиях.
(графит β- модификации, электронный газ и т.д. Указанные состояния исходных веществ (они называются стандартными состояниями) являются наиболее устойчивыми и распространенными в природных условиях.
Для всех веществ при температуре  :
:
 и
и  .
.
Химическая энергия  равна разности энергетических уровней исходных и конечных продуктов реакции и определяется строением молекул и атомов исходных и конечных веществ и не зависит ни от давления, ни от температуры. Для определения
равна разности энергетических уровней исходных и конечных продуктов реакции и определяется строением молекул и атомов исходных и конечных веществ и не зависит ни от давления, ни от температуры. Для определения  экспериментальным путем находят теплоту образования вещества
экспериментальным путем находят теплоту образования вещества  , т.е. количество тепла, которое выделяется (
, т.е. количество тепла, которое выделяется (  <0) или поглощается (
<0) или поглощается (  >0) при образовании данного вещества из указанных исходных веществ, взятых в стандартном состоянии:
>0) при образовании данного вещества из указанных исходных веществ, взятых в стандартном состоянии:
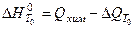 ,
,
где  обусловлена отличием теплоемкости исходных и конечных веществ, участвующих в реакции.
обусловлена отличием теплоемкости исходных и конечных веществ, участвующих в реакции.
При определении  для стандартных условий (температура
для стандартных условий (температура  или
или  и давление
и давление  ( 1 физ. атм.)
( 1 физ. атм.)  и
и 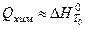 .
.
Для индивидуальных веществ при температуре Т
 ,
,
где 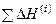 – сумма теплот фазовых и полиморфных превращений при изменении температуры от
– сумма теплот фазовых и полиморфных превращений при изменении температуры от  до Т.
до Т.
Полная энтальпия 1 кг двухкомпонентного топлива:
 .
.
Значения энтальпии горючего 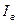 и окислителя
и окислителя  берут из таблиц при температуре подачи компонентов в камеру двигателя (20 или
берут из таблиц при температуре подачи компонентов в камеру двигателя (20 или  ) для высококипящих компонентов, или температуре кипения при давлении
) для высококипящих компонентов, или температуре кипения при давлении  для криогенных компонентов.
для криогенных компонентов.
Энтальпию одного условного моля двухкомпонентного топлива находят из соотношения
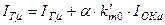 ,
,
где 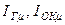 – энтальпия горючего и окислителя, отнесенные к одному молю.
– энтальпия горючего и окислителя, отнесенные к одному молю.
Энтальпия продуктов сгорания
 ,
,
где 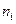 – число молей i-го вещества в ПС, образующееся из одного условного моля топлива.
– число молей i-го вещества в ПС, образующееся из одного условного моля топлива.
С учетом (4)
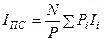 .
.
Общее число молей в 1 кг ПС 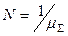 , где условная молекулярная масса ПС
, где условная молекулярная масса ПС 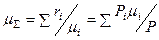 .
.
На основании последнего соотношения
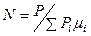
и энтальпия 1 кг ПС
 . (9)
. (9)
Здесь суммирование проводится с учетом всех веществ, содержащихся в ПС.
Дата добавления: 2015-01-19; просмотров: 134; Мы поможем в написании вашей работы!; Нарушение авторских прав |