
КАТЕГОРИИ:
АстрономияБиологияГеографияДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРиторикаСоциологияСпортСтроительствоТехнологияФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
ИНДИКАТОРЫ В МЕТОДЕ КИСЛОТНО-ОСНОВНОГО ТИТРОВАНИЯ
Кривая титрования характеризуется резким изменением рН в близи точки эквивалентности, которую называют скачком титрования. Чем больше скачок, тем точнее можно оттитровать определяемое вещество. По величине скачка выбирают индикатор.
Основное правило выбора индикатора. Для каждого данного титрования можно применять только такие индикаторы, показатель титрования которых (рТ индикатора) лежит в пределах скачка рН на кривой титрования
Индикаторами называются вещества, изменяющие свою окраску в зависимости от pH среды. По своей химической природе индикаторы представляют собой с л а б ы е кислоты HJnd илис л а б ы е основания JndOH, у которых молекулярная и ионная формы имеют различную окраску.
Согласно ионной теории индикаторов изменение цвета индикатора вызывается смещением равновесия диссоциации.

В кислой среде индикатор находится в недиссоциированной форме (HJnd), так как избыток ионов водорода связываетсяс анионами индикатора, — преобладает окраска I.
В щелочной среде гидроксильные ионы связывают протоны в малодиссоциированное вещество — воду. Равновесие смещаетсяв сторону диссоциации кислоты, что приводит к возрастанию концентрации ионной формы (Jnd ), — преобладает окраска II.
К уравнению (I) применим закон действующих масс:

При какой-то определенной реакции среды количество диссоциированных молекул индикатора будет равно количеству недиссоциированных молекул, т.е. [HJnd] = [Jnd ], тогда:
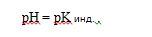
Это, так называемая, точка перехода окраски индикатора, когда индикатор имеет переходную (смешанную) окраску.
Сдвиг реакции среды в ту или иную сторону от точки перехода окраски сопровождается нарушением соотношения окрашенных форм индикатора и изменением цвета, указывающего на преобладание в растворе одной из форм индикатора. Окраску одной из форм индикатора можно различить, если концентрация ее в 10 раз превосходит концентрацию другой формы, что
объясняется чувствительностью глаза к определенным цветам. Тогда получим:

Таким образом, индикатор меняет свою окраску в интервале приблизительно двух единиц водородного показателя pH .
Согласно хромофорной теории индикаторов, изменение их окраски связано с обратимой перегруппировкой атомов в молекуле органического соединения. Такую обратимую перегруппировку в органической химии называют таутомерией. Если в результате таутомерного изменения строения в молекуле органического соединения появляются особые группировки (обычно с чередующимися двойными и одинарными связями), называемые хромофорами, органическое вещество приобретает окраску. Когда таутомерное превращение ведет к изменению строения хромофора — окраска
изменяется; если же после перегруппировки молекула не содержит более хромофора — окраска исчезает.
Таким образом, один и тот же индикатор может существовать в двух формах с разным строением молекул, причем эти формы могут переходить одна в другую, и в растворе между ними устанавливается равновесие.
О б л а с т ь з н а ч е н и й pH, в пределах которой наблюдается заметное для глаза изменение окраски индикатора, называется и н т е р в а л о м п е р е х о д а окраски индикатора (ИПО).
Титрование с различными индикаторами заканчивают в момент резкого изменения окраски индикатора. Точка перехода окраски каждого индикатора лежит примерно в середине интервала перехода окраски. Индикатор характеризуют показателем титрования рТ.
Показатель титрования рТ – это такое значение рН, при котором резко меняется окраска индикатора. Таким образом рТ определяет рН конечной точки титрования (КТТ).
Индикаторная ошибка титрования обусловлена тем, что рТ индикатора чаще всего не совпадает с рН в точке эквивалентности (ТЭ). Поэтому титрование заканчивается не в точке эквивалентности, а несколько раньше или позже. Вследствие этого раствор может быть либо несколько перетитрован
либо, наоборот, недотитрован и в конце титрования содержит избыток рабочего или анализируемого раствора.
Индикаторную ошибку титрования находят экспериментальнос помощью контрольного опыта или вычисляют.
При вычислении абсолютной ошибки титрования (∆n) находят избыточное или недостающее количество одного из реагирующих веществ. Чаще всего вычисляют не абсолютную (∆n), а относительную (δ) ошибку титрования и выражают ее в процентах:

|
| Индикаторные ошибки титрования |
Если учесть, что в качестве рабочих растворов обычно применяют сильные кислоты или основания, а определяют количество сильной кислоты или основания, слабой кислоты или основания и гидролизующейся соли, то индикаторные ошибки титрования можно разделить на две основные группы:
1) в момент изменения окраски индикатора (КТТ) в растворе находится
+
некоторый избыток свободной сильной кислоты (водородная ошибка δН )
-
или сильного основания (гидроксидная ошибка δОН );
2) в момент изменения окраски индикатора (КТТ) в растворе находится
некоторое количество недотитрованной слабой кислоты (кислотная ошиб-
ка), слабого основания (основная ошибка) или недотитрованной соли (соле-
вая ошибка).
Для каждого типа индикаторной ошибки применимы свои формулы рас-
чета. Поэтому предварительно надо установить тип ошибки. Для этого нужно
вычислить pH в точке эквивалентности и на основании сравнения значений
pH в точке эквивалентности и pТ индикатора определить тип ошибки данного
случая титрования.




12.Окислительно-восстановительное титрование.Классификация.
Дата добавления: 2015-01-29; просмотров: 321; Мы поможем в написании вашей работы!; Нарушение авторских прав |