
КАТЕГОРИИ:
АстрономияБиологияГеографияДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРиторикаСоциологияСпортСтроительствоТехнологияФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Электроды II рода.
Эти электроды пригодны и для определения анионов, образующих с ионами металла малорастворимыеили комплексные соединения. В этом случае их называют электродами II рода: в растворе, содержащем хлорид-ионы, потенциал серебряного электрода линейно зависит от активности хлорид-ионов

Потенциалы электродов II рода при достаточно большой площади поверхности воспроизводимы и устойчивы, поэтому они служат и электродами сравнения (хлорид серебряный, каломельный).
Электроды I и II рода применяют и в прямой (в настоящее время редко) и в косвенной потенциометрии. поэтому они служат и электродами сравнения (хлорид серебряный, каломельный).
Инертные металлические электроды изготовляют из благородных металлов (Pt, Au). Они служат переносчиками электронов от восстановленной формы к окисленной, и их потенциалы являются функцией соотношения активностей окисленной и восстановленной форм полуреакции. Эти электроды применяют в потенциометрическом окислительно-восстановительном титровании.
Если на электроды ячейки подавать постепенно увеличивающееся напряжение (разность потенциалов) и построить график зависимости тока через ячейку от потенциала электрода, то для каждого электрода получатся поляризационные, или вольт-амперные, кривые типа представленной на рис. П. 4.

Рис. П. 4. Поляризационная кривая
Сначала через ячейку проходит небольшой ток, называемый остаточным. Какая-то часть этого тока идет на заряжение электродов вследствие образования двойного электрического слоя на каждом электроде («нефарадеевский» ток, ток заряжения). Другая часть остаточного тока («фарадеевский» ток) расходуется на электролитические процессы, такие, как окисление или восстановление следов примесей. Затем ток начинает экспоненциально возрастать вследствие протекания основной электролитической реакции. Это происходит после того, как потенциал электрода превысит значение равновесного потенциала данной электродной реакции. Для протекания любой электродной реакции необходимо более или менее значительное перенапряжение (см.), тем большее, чем больше ток через систему. После достижения предельного тока (см.) данной реакции повышение потенциала может привести к протеканию новой реакции, т. е. к новому увеличению тока.
Метод основан на непосредственной зависимости потенциала индикаторного электрода от активности определяемых ионов в растворе, которая описывается уравнением Нернста:
Еи.э.= Е0 +  lg ax
lg ax
Для выполнения анализа необходимо иметь: систему электродов, потенциометр и исследуемый раствор.
Метод прямой потенциометрии, где индикаторным электродом служит ионоселективный электрод, называется ионометрией. Электродом сравнения служит хлоридсеребряный электрод. Ионометрию от других физико-химических методов анализа отличает простота методик и относительная дешевизна измерительных приборов.
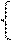 Уравнение для метода прямой потенциометрии, связывающее величину измеренного равновесного потенциала индикаторного электрода Еи.э. и активность определяемых ионов можно получить, решая систему уравнений:
Уравнение для метода прямой потенциометрии, связывающее величину измеренного равновесного потенциала индикаторного электрода Еи.э. и активность определяемых ионов можно получить, решая систему уравнений:
Еи.э. = Еэ.ср. – Еи.
Еи.э. = Е0исэ + S lg ax
где Еи – измеренный потенциал или ЭДС гальванического элемента; Еэ.ср. – потенциал электрода сравнения; S – угловой коэффициент (крутизна) электродной реакции; Е0исэ – стандартный потенциал ионоселективного электрода.
S = 
Решая систему уравнения, получим:
рХ = – lg ax =  ,
,
где К = Еэ.ср. – Е0исэ.
Существует три приема выполнения ионометрического анализа:
1. Метод градуировки электрода. Это самый быстрый и простой метод. чтобы оценить К нужно лишь измерить потенциал электрода в растворе с известной концентрацией определяемого иона. Градуировку электрода выполняют по буферным растворам. Но этот метод имеет существенный недостаток: необходимо принимать найденную по уравнению ах равной концентрации, т.к. μ и fа неизвестны. Также необходимо полагать, что К неизменна во всех случаях, а это весьма спорно. Поэтому по точности он уступает следующим приемам.
2. Метод градуировочного графика. Для серии стандартных растворов измеряют ЭДС гальванического элемента при постоянной ионной силе раствора. Для этого во все стандартные, а также анализируемые растворы вводят одинаковый избыток индифферентного электролита. Можно полагать, что ионная сила всех растворов одинакова (μ=const) и считать, что
Еи.э. = Е0исэ + S lg Cx.

| В соответствии с этим уравнением график в координатах Е = f(– lg Сх) линеен и описывается уравнением прямой. Направление изменения потенциала индикаторного электрода зависит от потенциала электрода сравнения. |
3. Метод добавок является оптимальным, особенно в случае анализа растворов сложного состава или при анализе очень разбавленных растворов. Метод основан на измерении потенциала индикаторного электрода в анализируемом растворе и после введения известного объема стандартного раствора (или известного количества стандартного вещества).
В качестве индикаторных электродов в методе прямой потенциометрии применяются ионоселективные электроды, потенциал которых зависит от концентрации одного определенного иона. В качестве электродов сравнения применяют электроды II рода.
Метод прямой потенциометрии широко применяется для определения рН растворов.
27Необходимо учесть множество факторов, таких как:
• Параметры анализируемой среды
a. Диапазон концентраций анализируемого иона
b. Температура и диапазон ее изменения, если она переменная
c. Наличие мешающих ионов
d. Наличие веществ, агрессивных к материалу электрода
е. Ограничения на объем пробы
f. Физическое состояние анализируемого материала
• Методика анализа
a. Метод - прямая потенциометрия, потенциометрическое титрование или методы добавок
b. Режим измерений - непрерывный или периодический
• Точность измерений
• Требования и ограничения со стороны применяемых измерительных приборов и прочего оборудования
а. Габаритные размеры электродов
b. Конфигурация электродов и форма чувствительной мембраны
с. Длина соединительного кабеля и тип разъема
Основной характеристикой измерительного электрода является диапазон определения. диапазон измерения электрода должен. Следующим по важности параметром идет температурный диапазон работы электрода
Ионометрия имеет довольно ограниченную область применения и в основном в лабораторной практике. Объясняется это в первую очередь тем, что большинство ионоселективных электродов не обладают высокой избирательностью (селективностью). С другой стороны наиболее привлекательный метод - прямая потенциометрия не позволяет проводить анализ с высокой точностью, прочие же потенциометрические методы более сложны и трудоемки. И третья особенность, ограничивающая применение метода это довольно узкий диапазон определения, для большинства ионоселективных электродов составляющий 4-6 порядков концентрации.
Стеклянные ионоселективные электроды из всех обладают наилучшими эксплуатационными характеристиками. Применение стеклянных электродов невозможно в растворах, содержащих плавиковую кислоту или ее соли.
Наиболее часто применяемыми электродами из этой группы являются Na - селективные. Модификации ЭЛИС-112Na и ЭЛИС-142Nа имеют одинаковые основные характеристиками, а отличаются устройством. Электрод ЭЛИС-142Na имеет твердый внутренний контакт. Электроды с твердым внутренним контактом обеспечивают наиболее стабильные параметры, особенно при эксплуатации их в жестких условиях. Однако они обладают более высокими потенциалами по сравнению с традиционными электродами (более минус 2000 мВ относительно хлорсеребряного электрода сравнения). Поэтому для работы с этими электродами нужны измерительные приборы со шкалой до 3000 мВ и более. ЭЛИС-112Na и ЭЛИС-142Na предназначены для лабораторного анализа растворов, содержащих достаточно высокие концентрации ионов Na+. Основным мешающим ионом являются ион водорода (Н+), поэтому при измерении должно соблюдаться соотношение pH-pNa > 3,5.
Электрод ЭЛИС-212Na предназначен для определения малых концентраций ионов Na в растворах. Измерения обычно проводятся в специальных проточных ячейках, с соблюдением предосторожностей от случайного загрязнения пробы. Для анализируемого раствора также должно соблюдаться соотношение величин pH-pNa > 3,5.
Стеклянный Li-селективный электрод имеет ограниченную область применения, поскольку он обладает равной чувствительностью к ионам Na.
Электроды с кристаллической мембраной. Электроды изготавливаются в пластиковых корпусах. Не допускается эксплуатация этих электродов в растворах, содержащих сильные окислители и органические растворители, разрушающие или растворяющие материал корпуса (ПВХ). При потере чувствительности электроды этого типа (все кроме фторидного) могут быть восстановлены зачисткой рабочей поверхности на мелкой шкурке.
F-селективный электрод является одним из самых высокоселективных электродов - единственным мешающим ионом является ион ОН-, поэтому измерения рекомендуется проводить при рН 5,5...6,5. Материал чувствительной мембраны - монокристалл LaF3 обладает высокой химической стойкостью и долговечностью, что обеспечивает значительный ресурс работы электрода. Зачистка рабочей поверхности электрода абразивными материалами не допускается.
CI-, Br-, I-селективные электроды выполнены по стандартной технологии. Материалом мембраны является прессованный порошок Ag2S с добавлением соответствующего галогенида серебра. Нижний предел диапазона измерения определяется растворимостью материала мембраны. Например, произведение растворимости AgCI равно 1,8x10-10, следовательно, в приэлектродном слое концентрация ионов Сl- составляет величину ПР=1,Зх10-5 моль/л, это и есть естественный предел обнаружения. Несколько расширить диапазон определения можно приемами, снижающими растворимость мембраны: охлаждение раствора, введение органических растворителей (не растворяющих ПВХ) или применение метода добавок.
Мешающим действием обладают все ионы, которые могут взаимодействовать с материалом мембраны с образованием менее растворимых солей, в частности это ионы Hg2+ и S2-. Селективность электродов возрастает в ряду CI-Br-I. Так для хлорид-селективного электрода Br- и I- являются мешающими ионами, а для определения йода при помощи соответствующего электрода ионы Cl- и Br- не мешают. Источником погрешностей и ошибок при анализе низких концентраций галогенидов может быть электролит, истекающий из электрода сравнения, обычно это насыщенный раствор KCI. В первую очередь этот эффект наблюдается при анализе хлоридов, однако он может проявляться и при анализе Br- и I-, т.к. cоль KCI, из которой готовится электролит для заправки электрода сравнения может содержать заметные количества прочих галогенидов. Поэтому при определении хлоридов обязательно, а бромидов и иодидов желательно применять двухключевой электрод сравнения, заправленный раствором KNO3, например ЭСр-10101.
Электроды обладают некоторой фоточувствительностью, поэтому не рекомендуется их эксплуатация и хранение под воздействием прямого солнечного света. Так же нежелательно присутствие в анализируемых растворах сильных окислителей или восстановителей.
Cd-, Pb-, Cu- селективные электроды также выполнены по общепринятой технологии. Материал мембраны - прессованный порошок Ag2S с добавлением сульфида соответствующего металла. Предел обнаружения определяется растворимостью сульфида металла. Рекомендации по расширению диапазона измерения те же, что и при определении галогенидов.
Мешающим действием обладают все ионы, которые могут взаимодействовать с материалом мембраны с образованием менее растворимых солей. При определении свинца следует применять двухключевой электрод сравнения, заправленный раствором KNO3 вместо KCI, для предотвращения засорения электролитического ключа малорастворимой солью PbCl2.
Для Ag-селективного электрода материалом мембраны служит прессованный порошок Ag2S. Мешающий ион Hg2+. При определении серебра следует применять двухключевой электрод сравнения, заправленный раствором KNO3 вместо KCl, т.к. малорастворимая соль AgCl может забивать электролитический ключ.
Электроды с ПВХ-мембраной. Материал мембраны ПВХ с добавлением специальных веществ- переносчиков. Мембрана требует бережного обращения, ее нельзя тереть или механически чистить. Материал корпуса тоже ПВХ. При работе с этими электродами не допускается присутствие веществ растворяющих или разрушающих ПВХ.
К-селективный электрод. При определении К+ должен применяться двухключевой электрод сравнения, заправленный раствором NH4NO3 или NH4Cl вместо KCl.
NO3-селективный электрод. Измерение нитратов достаточно широко применяется в аналитической практике для анализа сельскохозяйственной продукции, природных вод и почв при экологическом мониторинге. Следует иметь в виду то, что для каждого объекта исследований требуется своя методика анализа. Методика анализа твердых материалов, например, овощной продукции, обычно включает в себя: измельчение, экстракцию раствором квасцов и потенциометрическое исследование полученного раствора. При окончательном расчете содержания нитратов применяются специальные коэффициенты, учитывающие массу пробы, объем экстрагирующего раствора, разбавление, полноту извлечения и т.д. Эти коэффициенты устанавливаются на этапе разработки методики.
Ca-, NH4-селективные электроды не имеют каких-либо особенностей при эксплуатации.
Для комфортной работы с ионоселективными электродами, особенно при прямой потенциометрии, в качестве измерительного прибора нужен иономер. Конечно, может применяться и рН-метр с милливольтовой шкалой. В этом случае калибровочный график строится на бумаге и по нему определяется концентрация анализируемых ионов в растворе. Однако в настоящее время это практикуется редко. Кроме того, с развитием микропроцессорной техники появились измерительные приборы, реализующие различные методики измерения. Например, существуют приборы в программы, которых заложены методы добавок или титрование по методу Грана. И хотя отечественное приборостроение значительно отстает от западного, у нас легко найти производителя, который за очень умеренную плату разработает и заложит в свой прибор нужную потребителю методику измерений.
Титриметрические методы, в которых точку эквивалентности определяют по скачку потенциала на кривой титрования, называют потенциометрическим
титрованием. Этот метод установления точки эквивалентности отличается высокой точностью и воспроизводимостью и может быть использован в реакциях нейтрализации, окисления-восстановления, осаждения, комплексообразования.
В процессе титрования сначала происходит плавное изменение потенциала ячейки, а вблизи точки эквивалентности происходит его резкий скачок.
На кривой титрования точка эквивалентности является точкой перегиба.
Реакции нейтрализации
Н+ + ОН─ ↔ Н2О
В качестве индикаторного электрода обычно используется стеклянный электрод, в качестве электрода сравнения – хлорсеребряный или каломельный. Кривая титрования выражается зависимостью
РН = f (Vтитранта)
Вид кривой зависит от силы кислоты и основания и их концентраций в растворе.
1. Определяемое вещество – сильная кислота, титрант – сильное основание ( или наоборот)
Точка эквивалентности при РН = 7, величина скачка зависит от концентраций растворов. (см. рис)
2. Определяемое вещество – слабая кислота, титрант – сильное основание.
Точка эквивалентности при РН ≈ 8,8; скачок выражен слабее. В случае титрования слабого основания сильной кислотой значение РН точки эквивалентности сдвигается в кислую сторону.
3.Слабую кислоту раствором слабого основания эти методом оттитровать нельзя, т.к. кривая титрования не имеет выраженных скачков.
4. При титровании смеси кислот раствором сильного основания вполне удовлетворительные результаты могут быть получены, если константы диссоциации кислот отличаются друг от друга по крайней мере на три порядка. Кривая титрования имеет несколько перегибов, причем первый из них отвечает наиболее сильной кислоте.
Реакции осаждения и комплексообразования.
В качестве индикаторных используют мембранные электроды, потенциал которых является функцией концентрации (активности) ионов, принимающих участие в реакции. Величина скачка в точке эквивалентности зависит от величины произведения растворимости образующегося малорастворимого соединения или значения константы нестойкости образующегося комплексного соединения. Чем меньше эти величины, тем более резко происходит изменение потенциала в точке эквивалентности.
Реакции окисления-восстановления.
В качестве индикаторного используют электроды первого рода, чаще всего платиновые. Потенциал такого электрода определяется отношением концентраций окисленной и восстановленной формы одного иона:
Е = Ео + 0,059/n ∙ lg [Ox]/[Red]
При [Ox] = [Red] Е = Ео, где Ео – нормальный окислительно-восстановительный потенциал ситемы. Для стандартных термодинамических условий Ео многих окислительно-восстановительных систем – справочная величина.
Если в реакции титрования принимают участие ионы среды (Н+ или ОН─), то их концентрация учитывается уравнением Нернста:
a Ox + k H+ +n e─ = b Red + ½ m H2O
Е = Ео + 0,059/n ∙ lg [Ox] ∙[H+]k/[Red]
Пусть реакция титрования описывается схемой
n2 Red1 + n1 Ox2 ↔ n2 Ox1 + n1 Red2, где:
n2 (Ox1 + n1e─ ↔ Red1) - титруемый раствор
n1 (Ox2 + n2e─ ↔ Red2) - титрант
До точки эквивалентности потенциал индикаторного электрода определяется соотношением концентраций окисленной и восстановленной форм титруемого вещества:
Е = Ео1 + 0,059/n1 ∙ lg [Ox1]/[Red1]
Точка эквивалентности соответствует моменту, когда концентрации реагирующих веществ и продуктов реакции находятся в стехиометрическом соотношении:
n1/ n2 = [Red1] / [Ox2] = [Ox1] / [Red] или
[Ox1] / [Red1] = [Ox2] / [Red2], поэтому
Еэкв = n1Eo1 + n2Eo2 / n1n2
После точки эквивалентности потенциал системы определяется соотношением концентраций окисленной и восстановленной форм титранта:
Е = Ео2 + 0,059/n2 ∙ lg [Ox2]/[Red2]
Величина скачка на кривой потенциометрического титрования зависит от величин стандартных потенциалов окислителя и восстановителя. Для получения аналитической точности порядка 0,1% необходимая разность потенциалов должна быть не мене 0,35в при n=1 и 0,18в при n=2.
Важным свойством кривой титрования в этом методе является ее независимость от концентраций реагирующих веществ (теоретически). Следовательно, разбавление не должно оказывать влияние на точность определения точки эквивалентности.
Дата добавления: 2015-01-29; просмотров: 262; Мы поможем в написании вашей работы!; Нарушение авторских прав |