
КАТЕГОРИИ:
АстрономияБиологияГеографияДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРиторикаСоциологияСпортСтроительствоТехнологияФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Номенклатура солей. Название кислых, средних и основных солей
.Номенклатура солейОбщая формула соли МnAcm, где М – металл, Ас – кислотный остаток, n – число атомов металла, равное заряду иона кислотного остатка, m – число ионов кислотного остатка, равное заряду иона металла. Названия средних солей состоят из двух частей: названия аниона (кислотного остатка) в именительном падеже и катиона в родительном. Число катионов и анионов, как правило, не указывается. Если один и тот же металл проявляет различную степень окисления, то её указывают в скобках римской цифрой. Например, CuSO4 – сульфат меди (II); NaCl – хлорид натрия.
Названия кислых солей образуются добавлением к аниону приставки гидро-, и, если необходимо, то с соответствующим числительным. Например, NaHSO4 – гидросульфат натрия; KH2PO4 – дигидрофосфат калия.
Названия основных солей образуются добавлением к аниону приставки гидроксо-, и, если необходимо, то с соответствующим числительным. Например, AlOHSO4 – гидроксосульфат алюминия; Fe(OH)2Cl – дигидроксохлорид железа (III).
Названия двойных солей состоят из двух частей: названия аниона в именительном падеже и катионов в родительном. Число катионов и анионов, как правило, не указывается. Если один и тот же металл проявляет различную степень окисления, то её указывают в скобках римской цифрой. Например, KAl(SO4)2 – сульфат алюминия – калия; NH4MgPO4 – фосфат магния – аммония; (NH4)2Fe(SO4)2 – сульфат железа (II) – аммония.
Названия комплексных соединений состоят из двух частей: внутренней и внешней сферы, причем вся внутренняя сфера называется одним словом. Названия лигандов – анионов оканчиваются соединительной гласной -о-. При этом для одноэлементных анионов соединительная гласная -о-добавляется к корню названия элемента, например, Cl- – хлоро-, а для многоэлементных кислородсодержащих анионов соединительная гласная присоединяется к традиционным или систематическим названиям анионов, например, SO32- – сульфито-; ОН- – гидроксо-; CN- – циано-. Названия молекул, являющихся лигандами, оставляют без изменения, например, C2H4 – этилен; но Н2О называют аква-, NH3 – аммин-, СО – карбонил-.
При названии соединений с комплексным анионом комплексообразователь называют по-латински, добавляя суффикс -ат. Степень окисления комплексообразователя указывают римскими цифрами в скобках после названия комплексного аниона. Число лигандов обозначают с помощью греческих числительных: 1 – моно-, 2 – ди, 3 – три, 4 – тетра, 5 – пента, 6 – гекса. Название катиона указывают в родительном падеже. Например, Na[Al(OH)4] – тетрагидроксоалюминат натрия; K3[Cu(CN)4] – тетрацианокупрат (I) калия; (NH4)2[Hg(NCS)4] – тетрароданомеркурат (II) аммония.
При названии соединений с комплексным катионом комплексообразователь называют по-русски в родительном падеже. Степень окисления комплексообразователя указывают римскими цифрами в скобках после названия. Название аниона указывают в именительном падеже. Например, [Ag(NH3)2]Cl – хлорид диамминсеребра (I); [Pt(NH3)3Cl]Cl – хлорид хлоротриамминплатины (II); [Co(H2O)6]Br2 – бромид гексааквакобальта (II).
В названии комплексного соединения, состоящего только из внутренней сферы, степень окисления комплексообразователя не указывается, так как она однозначно определяется исходя из электронейтральности комплекса. Название комплексообразователя приводится по-русски в именительном падеже. Например, [Co(H2O)3F3] – трифторотриаквакобальт; [Cr(NH3)2Cl2] – дихлородиамминхром; [Pt(NH3)2Cl4] – тертахлородиамминпланита.
Многие соли имеют традиционные названия, например:Pb2(CO3)(OH)2 – свинцовые белила;KCr(SO4)2·12H2O – хромкалиевые квасцы; CuSO4·5H2O – медный купорос; NaHCO3 – сода питьевая; K4[Fe(CN)6] – желтая кровяная соль и др.
Соли – это сложные вещества, образованные атомами металлов и кислотными остатками.
С точки зрения теории электролитической диссоциации соли - это электролиты, диссоциирующие в водных растворах на катионы металлов и анионы кислотных остатков.Соли бывают средние (нормальные), кислые и основные.
Средние соли – это продукты полного замещения водорода в кислоте на атомы металла или гидроксогруппы ОН- в основании на кислотный остаток. Например: имеем серную кислоту H2SO4. Средние соли этой кислоты будут иметь состав Na2SO4, CaSO4, Al2(SO4)3. Средние соли ортофосфорной кислоты H3PO4: К3PO4, Ca3(PO4)2, AlPO4. Средние соли в водных растворах диссоциируют всегда в одну ступень:NaCI Na+ + CI - Al2(SO4)3 2AI3+ + 3SO42-.
Кислые соли можно рассматривать как продукты неполного замещения атомов водорода кислоты на атомы металлов. Кислые соли могут быть образованы только от многоосновных кислот.Хлороводородная кислота HCl кислых солей не имеет. Серная кислота H2SO4 образует кислые соли в состав которых входит анион HSO4-: NaHSO4, Cu(HSO4)2, Fe(HSO4)3. Фосфорная кислота Н3РО4 имеет два типа кислых солей: с анионами Н2РО4-, НРО42-.
Кислые соли диссоциируют ступенчато:KH2PO4 K+ + H2PO4-, H2PO4- 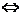 H+ + HPO42-, HPO42-
H+ + HPO42-, HPO42- 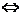 H+ + PO43-,
H+ + PO43-,
Кислые соли чаще всего образуются в избытке кислоты: Mg(OH)2 + 2H2SO4  Mg(HSO4)2 + 2H2O. кислая соль Mg(OH)2 + H2SO4
Mg(HSO4)2 + 2H2O. кислая соль Mg(OH)2 + H2SO4  MgSO4 + 2H2O средняя соль
MgSO4 + 2H2O средняя соль
Основные соли можно рассматривать как продукты неполного замещения ионов ОН- основания на ионы кислотных остатков. Они могут быть образованы только многокислотными основаниями.Гидроксиды щелочных металлов основных солей не имеют.
Гидроксиду меди Сu(ОН)2 соответствуют основные соли с катионом СuОН+: CuOHNO3, (CuOH)2SO4, (CuOH)3PO4.
Гидроксид хрома (III) Cr(ОН)3 образует два ряда основных солей с катионами Cr(ОН)2+, CrОН2+:
Дата добавления: 2015-01-29; просмотров: 445; Мы поможем в написании вашей работы!; Нарушение авторских прав |