
КАТЕГОРИИ:
АстрономияБиологияГеографияДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРиторикаСоциологияСпортСтроительствоТехнологияФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Дайте определение и физическую сущность энтальпии.
Энтальпи́я, также тепловая функция и теплосодержание — термодинамический потенциал, характеризующий состояние системы в термодинамическом равновесии при выборе в качестве независимых переменных давления, энтропии и числа частиц.
Проще говоря, энтальпия — это та энергия, которая доступна для преобразования в теплоту при определенных температуре и давлении.
Если термомеханическую систему рассматривать как состоящую из макротела (газа) и поршня площадью S с грузом весом Р = pS, уравновешивающего давление газа р внутри сосуда, то такая система называется расширенной.
Энтальпия или энергия расширенной системы Е равна сумме внутренней энергии газа U и потенциальной энергии поршня с грузом Eпот = pSx = pV
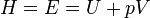
Таким образом, энтальпия в данном состоянии представляет собой сумму внутренней энергии тела и работы, которую необходимо затратить, чтобы тело объёмом V ввести в окружающую среду, имеющую давление р и находящуюся с телом в равновесном состоянии. Энтальпия системы H — аналогично внутренней энергии и другим термодинамическим потенциалам — имеет вполне определенное значение для каждого состояния, т. е. является функцией состояния. Следовательно, в процессе изменения состояния

8.Что такое Термохимия, ее основные законы и следствия из них : закон Лавуазье-Лапласа,закон Гесса.
Термохи́мия — раздел химической термодинамики, в задачу которой входит определение и изучение тепловых эффектов реакций, а также установление их взаимосвязей с различными физико-химическими параметрами. Ещё одной из задач термохимии является измерение теплоёмкостей веществ и установление их теплот фазовых переходов.
Основная статья: Закон Гесса
В основе термохимических расчётов лежит закон Гесса: Тепловой эффект (∆Н) химической реакции (при постоянных Р и Т) зависит от природы и физического состояния исходных веществ и продуктов реакции и не зависит от пути её протекания.
Следствия из закона Гесса:
- Тепловые эффекты прямой и обратной реакций равны по величине и противоположны по знаку.
- Тепловой эффект химической реакции (∆Н) равен разности между суммой энтальпий образования продуктов реакции и суммой энтальпий образования исходных веществ, взятых с учётом коэффициентов в уравнении реакции (то есть помноженные на них).
Закон Гесса может быть записан в виде следующего математического выражения:
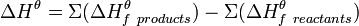 .
.
С помощью закона Гесса можно рассчитать энтальпии образования веществ и тепловые эффекты реакций, которые невозможно измерить экспериментально.
Первый в термохимии закон был сформулирован одновременно двумя исследованиями двух ученых и называется законом Лавуазье–Лапласа.
Тепловой эффект образовавшегося химического соединения равен тепловому эффекту его разложения, но с обратным знаком . Теплотой образования химического соединения называется изменение энтальпии при образовании 1 моль химического соединения из элементов
Са(тв) + С(тв) + 1,5 О2(г) = CaCO3 (тв) Н°298 = -1207 кДж/моль Другой важной характеристикой термохимических величин является теплота сгорания химического соединения. Теплота сгорания представляет собой изменение энтальпии при полном окислении 1 моля химического соединения .
С6H6(ж.) + 7,5 O2(г) = 6СО2(г) + 3Н2О(ж); Н° =-3280 кДж/моль.
Дата добавления: 2015-01-29; просмотров: 205; Мы поможем в написании вашей работы!; Нарушение авторских прав |