
КАТЕГОРИИ:
АстрономияБиологияГеографияДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРиторикаСоциологияСпортСтроительствоТехнологияФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Связь константы диссоциации и степени диссоциации
Исходя из определения степени диссоциации, для электролита КА в реакции диссоциации [A−] = [K+] = α·c, [KA] = c — α·c = c·(1 — α), где α — степени диссоциации электролита.
Тогда:
 , ,
|
Это выражение называют законом разбавления Оствальда. При очень малых α (α<<1) K=cα² и
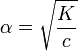
таким образом, при увеличении концентрации электролита степень диссоциации уменьшается, при уменьшении — возрастает.
17. Слабые электролиты. Степень диссоциации. Константа диссоциации.
Слабые электролиты - электролиты, степень электролитической диссоциации которых в растворах значительно меньше единицы и сильно меняется с изменением концентрации раствора.
Константа диссоциации кислоты (Ka) — константа равновесия реакции диссоциации кислоты на ион водорода и анион кислотного остатка. Для многоосновных кислот, диссоциация которых проходит в несколько стадий, оперируют отдельными константами для разных стадий диссоциации, обозначая их как Ka1, Ka2 и т. д.
Степень диссоциации — это отношение числа молекул, распавшихся на ионы, к общему числу растворившихся молекул.
18.Зависимость степени диссоциации слабого электролита от концентрации раствора. Закон разбавления Оствальда.
Степень диссоциации как сильных, так и слабых электролитов зависит от концентрации раствора (степень диссоциации тем выше, чем более разбавлен раствор).
 Закон разбавления Оствальда — соотношение, выражающее зависимость эквивалентной электропроводности разбавленного раствора бинарного слабого электролита от концентрации раствора:
Закон разбавления Оствальда — соотношение, выражающее зависимость эквивалентной электропроводности разбавленного раствора бинарного слабого электролита от концентрации раствора:
 Здесь К — константа диссоциации электролита, с — концентрация, λ и λ∞ — значения эквивалентной электропроводности соответственно при концентрации с и при бесконечном разбавлении. Соотношение является следствием закона действующих масс и равенства
Здесь К — константа диссоциации электролита, с — концентрация, λ и λ∞ — значения эквивалентной электропроводности соответственно при концентрации с и при бесконечном разбавлении. Соотношение является следствием закона действующих масс и равенства
где α — степень диссоциации.
Закон разбавления Оствальда выведен В.Оствальдом в 1888 и им же подтвержден опытным путём. Экспериментальное установление правильности закона разбавления Оствальда имело большое значение для обоснования теории электролитической диссоциации.
19. Равновесие в растворах слабых электролитов. Влияние одноимённого и связывающего ионов.
В растворах слабых электролитов устанавливается равновесие между недиссоциированными молекулами и продуктами их диссоциации - ионами.
Влияние посторонних веществ на степень диссоциации слабого электролита зависит от природы вводимых ионов. Здесь можно выделить 2 случая: присутствие либо одноименных, либо связывающих ионов.
Изменение концентрации одного из ионов, образующегося при диссоциации данного слабого электролита, согласно принципу Ле Шателье смещает положение равновесия. Если в систему вводятся одноименные ионы, то есть увеличивается концентрация одного из образующихся при диссоциации ионов, то равновесие смещается в сторону недиссоциированных молекул этого электролита. Степень диссоциации слабого электролита уменьшается.
Если в раствор слабого электролита вводятся связывающие ионы, то происходит связывание одного из продуктов диссоциации слабого электролита, что приводит к смещению равновесия диссоциации этого вещества в сторону ионной формы. Степень диссоциации слабого электролита увеличивается.
20.Амфотерные гидроксиды с точки зрения теории электролитической диссоциации.
Амфотерные электролиты могут находиться в осадке и в растворе в виде молекул и диссоциировать по типу кислоты и основания. Например, слабыми электролитом является гидроксид цинка. Его диссоциацию можно представить в виде схемы:
Zn(OH)2 (осадок)
↕
2H+ + ZnO22- ↔ H2ZnO2 ↔ (раствор) Zn(OH)2 ↔ Zn2+ + OH-
Добавление кислоты или целочи вызывает растворения осадка, так как и в том, и в другом случае связываются ионы ОН- или Н+, что приводит к образованию слабого электролита Н2О
В первом случае равновесие диссоциации смещается в сторону ионной формы основания (вправо), во втором – в сторону ионной формы кислоты (вправо)
21.Сильные электролиты. Активная концентрация. Ионная сила раствора.
1)Электролиты – это вещества, растворы и расплавы которых проводят электрический ток. Сильные электролиты - это вещества, которые при растворении практически полностью диссоциируют на ионы. К сильным электролитам относятся почти все соли, некоторые кислоты (НСl, HBr, HI, НNО3, НсlO4, Н2SO4(разб.)) и некоторые основания (LiОН, NaOH, КОН, Са(ОН)2, Sr(OH)2, Ва(ОН)2). И.А Каблуков установил причины полной диссоциации сильных электролитов в растворах: в водных растворах сильные электролиты полностью диссоциируют за счет ион-дипольного взаимодействия с молекулами воды. Продукты взаимодействия - гидратированные ионы.
2) Активная концентрация - концентрация свободных гидратированных ионов в растворе.
3)Ионная сила раствора равна полусумме произведений молярных концентраций всех присутствующих ионов на квадраты их зарядов:
μ= 1/2(c1z1² + c2z2² + ... + cnzn²) = 1/2 Σсizi²
Этот параметр нужен для определения коэффициента активности иона. С увеличением ионной силы раствора коэффициент активности уменьшается.
Сильные электролиты – это электролиты, которые в водных растворах диссоциируют практически полностью. Истинная степень их диссоциации близка к 100%, однако экспериментально наблюдаемая находится в пределах от 30% и выше.
22.Диссоциация воды. Ионное произведение воды. Водородный показатель рH.
Диссоциация воды - разложение воды на составляющие химические элементы, иногда происходящая с созданием новых элементов, изначально в разлагаемом растворе не содержащихся, или содержащихся до начала разложения в меньшем количестве, чем после завершения процесса диссоциации.
1)Чистая вода, хоть и плохо (по сравнению с растворами электролитов), но может проводить электрический ток. Вода является слабым электролитом, в малой степени диссоциирует на ионы: Н2О ↔ H+ + OH-
2)Ионное произведение воды, произведение концентраций (точнее активностей) ионов водорода Н+ и ионов гидроксила OH- в воде или в водных растворах: Kв = [Н+] [ОН-], где Kв - постоянная величина, называемая ионное произведение воды.
3)Водородный показательрH -величина, характеризующая концентрацию ионов водорода; равна отрицательному десятичному логарифму концентрации ионов водорода. В нейтральной среде Ph = 7, в кислых средах < 7, в щелочных >7.
- это функция отрицательного десятичного логарифма концентрации катионов водорода рH = - lg[H+] или [H+] = 10-pH, где [H+] - концентрация ионов водорода, моль/л. Вспомогательные формулы: [H+] = 10-14/ [OH-] . рH может быть выражен через ионное произведение воды: Kw = [H+][OH-] = 10-14 ; рH может быть выражен: [Н+] = См α n[H-] где См - молярная концентрация, α - кажущаяся степень диссоциации, n - количество катионов водорода в кислоте. [OH-] = См α n[ОH-]
23.Гидролиз солей. Роль в живом организме.
1) Гидролиз соли – взаимодействие ионов соли с водой, приводящее к образованию слабого электролита. Гидролиз соли на примере ацетата натрия - сильный электролит, при растворении в воде полностью диссоциирует на ионы Na+ и CH3COO- . Суммарное ур-е протекающих процессов имеет вид: CH3COO- + Н2О ↔ CH3COOH + OH- . Cуществует константа гидролиза Кг , равная Кг =Кв/Кк где Kв - постоянная величина, называемая ионное произведение воды, Кк - константа диссоциации слабой кислоты, образованной в результате гидролиза соли.
2) Гидролизу подвергаются соли, образованные: а) сильным основанием и слабой кислотой; б) сильной кислотой и слабым основанием; в) слабым основанием и слабой кислотой.
3) Важной стадией процесса пищеварения является гидролиз пищи в желудочно-кишечном тракте. Энергия в живых организмах запасается, в основном, в виде АТФ и выделяется при ее гидролизе.
Процесс ферментативного гидролиза играют важную роль в пищеварении и тканевом обмена веществ всех живых организмов, играет важную роль в регуляции кислотной среды и в поддержании в организме кислотно-щелочного равновесия.
24.Современная модель состояния электрона в атоме. Квантовые числа. Принцип Паули.
Атом с более чем одним электроном представляет собой сложную систему взаимодействующих друг с другом электронов, движущихся в поле ядра.
Электроны в атоме притягиваются к ядру, между электронами также действует кулоновское взаимодействие. Эти же силы удерживают электроны внутри потенциального барьера, окружающего ядро. Для того, чтобы электрон смог преодолеть притяжение ядра, ему необходимо получить энергию от внешнего источника. Чем ближе электрон находится к ядру, тем больше энергии для этого необходимо.
1) С точки зрения квантовой или волновой механики, электрон - это такое образование, которое ведёт себя и как частица, и как волна, т.е. он обладает корпускулярно-волновым дуализмом (двойственностью). Т.о. электроны могут производить давление, а движущийся поток электронов обнаруживает волновые явления, например дифракцию электронов. Представим корпускулярно-волновой дуализм как частицу и выразим через ур-е Луи де Бройля: λ = h/mv , где λ - длина волны, h - постоянная Планка(6,63х10 в степени -34, Дж с), m - масса, v - скорость микрочастицы.
Электрон находится в пространстве рядом с ядром, но т.к. он постоянно в движении можно рассматривать лишь совокупность его расположений - т.е. электронное облако, т.о. эл. облако - это квантово-механическая модель движения электрона в атоме. Плотность эл. облака неравномерна - часть атомного пространства, где электрон пребывает больше всего, плотней.
Электроны распределяются по энергетическим уровням (слоям/оболочкам).
2) Квантовые числа определяют состояние электрона в атоме, точнее - на каком энергетическом уровне электрон находится.
Главное квантовое число (n) - характеризует энергию электрона и размеры электронного облака. Принимает значения целых чисел от 1 до 7 соответственно номеру периода, в котором находится элемент.
Орбитальное (побочное или азимутальное) квантовое число(l) - характеризует энергетическое состояние электрона в подуровне и форму облака. Принимает значения на единицу меньше, чем n.
Магнитное квантовое число(m) - характеризует орбитали в пространстве и связано с числом l. m = 2l + 1
Спиновое квантовое число (s) - характеризует собственное вращение электрона вокруг своей оси. Это вращение называется спин и принимает только два значения +1/2, -1/2.
3) По принципц Паули на одной орбитали может находится 2 электрона с противоположными спинами: на s-подуровне = 2 электрона, на p-подуровне = 6 эл., на d-подуровне = 10, на f-подуровне = 14. Число электронов на подуровне определяется уравнением Nl = 2(2l + 1).
25.Распределение электронов в атоме. Правило Хунда.
Распределение электронов в атоме по уровням и подуровням(орбиталям) изображаются в виде электронных формул. Орбиталь с минимальной энергией - это 1s-орбиталь. Её занимает единственный электрон атома водорода, поэтому электронная формула атома водорода записывается 1s1. У гелия эл. формула 1s² . Т.к. на s-подуровне могут быть только 2 электрона, то эл.формулы последующих элементов записываются уже с заполнением последующих подуровней после s-подуровня, например бериллий 1s²2s², неон 1s²2s²2p6.
Правило Хунда: электроны располагаются на одинаковых орбиталях таким образом, чтобы суммарный спин был максимальным.
графический пример заполнения эл.орбиталей:


26.Периодический закон с точки зрения строения атома. Причины периодичности.
Менделеев считал, что основной характеристикой элементов являются их атомные веса, и в 1869 г. впервые сформулировал периодический закон: свойства простых тел, а также формы и свойства соединений элементов находятся в периодической зависимости от величины атомных весов элементов. На базе современных представлений периодический закон формулируется так:
Дата добавления: 2015-01-29; просмотров: 232; Мы поможем в написании вашей работы!; Нарушение авторских прав |