
КАТЕГОРИИ:
АстрономияБиологияГеографияДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРиторикаСоциологияСпортСтроительствоТехнологияФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Третий закон термодинамики.
Третий закон термодинамики устанавливает, что энтропия физической системы при стремлении температуры к абсолютному нулю не зависит от параметров системы и остается неизменной. (В формулировке М.Планка энтропия S = 0 при T = 0 К.)
Проследим изменение энтропии по мере нагревания ионного кристалла. В идеальном ионном кристалле вблизи абсолютного нуля температуры существует наивысший порядок. Его можно сравнить со строем хорошо обученных солдат, стоящих по стойке смирно.
Нагревание первоначально приведет к незначительным смещениям ионов от положений равновесия в виде слабых колебаний. Так и ослабление внимания командира к строю солдат может привести к их некоторому шевелению.
Последующее нагревание ионного кристалла приведет к качественному скачку из твердого состояния в жидкое. А при отсутствии внимания к строю в течение длительного времени вполне вероятно образование кучки солдат.
Нагревание же жидкой фазы сопровождается все возрастающей подвижностью, пока не произойдет качественный скачок – жидкость превратится в газ. Так и солдаты разбегутся из кучи в разные стороны по команде «Разойдись!».
Все вышесказанное наглядно отображает качественная зависимость энтропии ионного кристалла от температуры (рис. 6.3).
| Рис. 6.3. Качественная зависимость энтропии ионного кристалла от температуры |
Приведенный график демонстрирует, что энтропия жидкости обычно гораздо выше, чем энтропия твердого тела, а энтропия газа выше, чем энтропия соответствующей жидкости. Это означает, что с точки зрения второго закона термодинамики жидкостью быть более выгодно, чем твердым телом, а газом – выгоднее, чем жидкостью.
Таким образом, для самопроизвольного протекания реакции требуется, с одной стороны, уменьшение суммы энтальпий: если сумма энтальпий образования продуктов меньше суммы энтальпий образования реагентов, т.е. 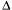 Н < 0, то такой процесс энергетически выгоден. С другой стороны, самопроизвольно может протекать лишь процесс, в котором сумма энтропий продуктов превышает сумму энтропий реагентов, т. е. изменение энтропии в ходе процесса должно быть положительным (
Н < 0, то такой процесс энергетически выгоден. С другой стороны, самопроизвольно может протекать лишь процесс, в котором сумма энтропий продуктов превышает сумму энтропий реагентов, т. е. изменение энтропии в ходе процесса должно быть положительным ( 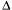 S > 0).
S > 0).
Дата добавления: 2015-01-29; просмотров: 74; Мы поможем в написании вашей работы!; Нарушение авторских прав |