
КАТЕГОРИИ:
АстрономияБиологияГеографияДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРиторикаСоциологияСпортСтроительствоТехнологияФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
При постоянных давлении и температуре самопроизвольно протекают только такие химические реакции, которые сопровождаются уменьшением энергии Гиббса.
Иными словами, ∆G < 0 (т.е. энергия Гиббса системы в исходном состоянии больше, чем в конечном) свидетельствует о возможности самопроизвольного осуществления реакции. Если же ∆G > 0, то процесс не может идти в данных условиях.
Используя известные значения стандартных энтальпий образования и стандартных энтропии веществ, можно прогнозировать возможность протекания химической реакции при той или иной температуре.
Под стандартной энергией Гиббса образования понимают изменение энергии Гиббса при реакции образования 1 моль данного соединения из простых веществ. Подобно энтальпии и энтропии:
Стандартное изменение энергии Гиббса в ходе химической реакции равно сумме стандартных энергий Гиббса образования продуктов реакции за вычетом суммы стандартных энергий Гиббса образования исходных веществ.
Пользуясь табличными данными можно рассчитать изменение энергии Гиббсав стандартных условиях.
Рассмотрим обратимую реакцию:
N2 (г) +ЗН2 (г) ↔ 2NH3(г) .
Для стандартных условий ∆H° = - 92,4кДж ∆S°= -0,1978 кДж/К
Изменение энергии Гиббса:
∆G0 = ∆H0 - T∆S0 = -92,4 - (0,198 ∙ 298) = 92,4 + 59,0 = -33,4 кДж.
Итак, при стандартных условиях реакция протекает в прямом направлении, хотя она сопровождается уменьшением энтропии (превалирует энтальпийный фактор). Обратная реакция — разложение аммиака на водород и азот — в этих условиях термодинамически (принципиально) невозможна.
Однако по мере повышения температуры все более существенным становится влияние энтропийного фактора.
∆G500 = 6,6 кДж,
∆G800 = 66,0 кДж.
В случае обратной реакции ∆G имеют, естественно, противоположные знаки. Уже при 500К становится принципиально возможным разложение аммиака. При 800К эта возможность возрастает.
Когда действия энтальпийного и энтропийного факторов уравновешивают друг друга, т.е. ∆G=0, наступает состояние химического равновесия. В этом случае скорость прямой реакции равна скорости обратной.
Константа химического равновесия связана с изменением энергии Гиббса уравнением: ΔGреак. = -RT In К
Изменение энергии Гиббса определяет лишь возможность протекания химических реакций. В конкретных условиях скорость протекания реакции может быть бесконечно мала. Это обусловлено барьером энергии активации, при нагревании или освещении солнечным светом реакция немедленно произойдет.
24) Энтальпийный и энтропийный факторы процесса
НЕ СМОГЛА НАЙТИ!
 25) Термодинамический анализ реакции.
25) Термодинамический анализ реакции.
26)Зависимость энергии Гиббса от температуры
27.Закон действующих масс, его кинетическая интерпретация, применение для гомогенных и гетерогенных процессов
Само явление катализа – это кинетическое явление, связанное с увеличением скоростей химических реакций под воздействием катализаторов. Наиболее научно обоснованным определением каталитической активности с точки зрения формальной кинетики является следующее: каталитическая активность – это удельная (на единицу массы, объема, поверхности) стационарная скорость каталитической реакции при заданных температуре, давлении и составе реакционной смеси.
Гетерогенная каталитическая реакция всегда проходит по крайней мере в пять последовательных стадий: транспорт реагентов к поверхности катализатора, адсорбция реагентов, каталитическое превращение на поверхности (которое может проходить в несколько стадий), десорбция продуктов реакции и их транспорт с поверхности катализатора. Общая скорость реакции не может быть больше скорости самой медленной из этих стадий.
Мерой каталитической активности обычно считают удельную (на единицу поверхности) константу скорости изучаемой реакции. Более точной величиной является константа скорости в расчете на один центр катализатора. Однако число каталитически активных центров на единице поверхности обычно остается неизвестным, и практически используется первое определение. В обоих случаях необходимо, чтобы скорость реакции не зависела от процессов транспорта веществ, т.е. была заметно меньшей. В противном случае константа скорости определяется не только поверхностью, но и пористой структурой катализатора. Следует отметить важную особенность гетерогенных каталитических реакций: кинетические параметры каталитических реакций далеко не всегда удается сопоставить со свойствами элементарного акта катализа.
Кинетические уравнения для химических процессов строят, исходя из предположения, что скорость реакции, протекающий в один элементарный акт, пропорциональна концентрациям реагентов в степенях, равных стехиометрическим коэффициентам в уравнении реакции. Это закон действия масс в химической кинетике, применимый как для гомогенных, так и для гетерогенных реакций. Для сложных процессов, к которым относятся и все каталитические реакции, этот закон применим только к отдельным стадиям процесса, а общая скорость может зависеть от концентраций всех или только некоторых веществ, присутствующим в системе. При этом показатели степеней в кинетическом уравнении в общем случае не будут равны стехиометрическим коэффициентам в уравнении реакции.
Для гетерогенных процессов роль одного из реагентов играют адсорбционные центры носителя, которые и следует включать в соответствующие уравнения. При этом под свободным адсорбционным центром подразумевается только набор одинаковых во всех отношениях центров адсорбции. Для энергетически неоднородной поверхности различные центры адсорбции приходится учитывать так же, как и различные по своей природе молекулы в газовой фазе, т.е. каждому типу центров адсорбции соответствует отдельное уравнение типа приведенного ниже.
Например, для адсорбции газа А,
А(газ) + 1 адс. центр = А(адс.)
РА q 0 q А
в соответствии с законом действия масс скорость адсорбции будет равна
Vадс. = kадс.рАq0,
где рА – парциальное давление компонента А и q 0 – доля свободной поверхности – пропорциональны концентрациям реагентов.
Аналогично скорость десорбции запишется в виде:
Vдес. = kдес. qA
Приведенное уравнение относится к отдельно взятым элементарным стадиям адсорбции или химических превращений. Кинетические уравнения для процесса в целом должны выражать скорость реакции через измеряемые на опыте величины – парциальные давления веществ, присутствующих в системе.
Для составления таких уравнений необходимо знать и постулировать механизм реакции. Под этим подразумевается знание природы элементарных стадий, через которые система проходит от исходных веществ к продуктам реакции, и относительных скоростей отдельных процессов.
Для примера рассмотрим мономолекулярное гетерогенное превращение
Аадс. ® Вадс.
Здесь V = kq = k  (5)
(5)
Существенное отличие гетерогенного процесса от гомогенного состоит в том, что при заданном типе элементарного процесса порядок реакции и эффективная энергия активации зависят от адсорбционной способности всех присутствующих в системе веществ.
При слабой адсорбции продуктов реакции bB PB << 1 и по мере увеличения сорбируемости исходного вещества уравнение (5) приобретает вид
V = kbAPA при bAPA << 1,
V = k 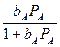
 при bAPA » 1,
при bAPA » 1,
V = k при bAPA >> 1.
Этому отвечает изменение порядка реакции по веществу А от 1 до 0 и изменение эффективной энергии активации от Еист. - lА до Еист., где lА – энергия адсорбции А.
В случае сильной и средней адсорбции продуктов реакции уравнения приобретают другой вид.
Основная трудность изучения механизмов сложных реакций: найденные на опыте кинетические соотношения можно получить теоретически исходя из различных предположений о механизме процесса. Исходя только из кинетических уравнений, нельзя обосновать один из этих механизмов. Можно лишь исключить те механизмы, которые противоречат найденным на опыте кинетическим закономерностям.
28. Размерные константы равновесия, их взаимосвязь.
Константа равновесия может оказаться размерной или безразмерной величиной в зависимости от вида ее математического выражения. В приведенном выше примере константа равновесия является безразмерной величиной, поскольку числитель и знаменатель дроби имеют одинаковые размерности. В противном случае константа равновесия имеет размерность, выражаемую в единицах концентрации или давления.
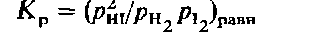
Расчётные методы определения константы равновесия реакции обычно сводятся к вычислению тем или иным способом стандартного изменения энергии Гиббса в ходе реакции (ΔG0), а затем использованию формулы:
 , где
, где  — универсальная газовая постоянная.
— универсальная газовая постоянная.
При этом следует помнить, что энергия Гиббса — функция состояния системы, то есть она не зависит от пути процесса, от механизма реакции, а определяется лишь начальным и конечным состояниями системы. Следовательно, если непосредственное определение или расчёт ΔG0 для некоторой реакции по каким-либо причинам затруднены, можно подобрать такие промежуточные реакции, для которых ΔG0 известно или может быть легко определено, и суммирование которых даст рассматриваемую реакцию (см. Закон Гесса). В частности, в качестве таких промежуточных реакций часто используют реакции образования соединений из элементов.
Дата добавления: 2015-01-29; просмотров: 222; Мы поможем в написании вашей работы!; Нарушение авторских прав |