
КАТЕГОРИИ:
АстрономияБиологияГеографияДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРиторикаСоциологияСпортСтроительствоТехнологияФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Идеальные и неидеальные растворы
Идеальным называется раствор, образование которого из компонентов не сопровождается тепловым эффектом и изменением объема: ΔН=0, ΔV=0. В идеальном растворе энергии взаимодействия всех видов молекул одинаковы.Такие растворы образуют, например, соседние гомологи в ряду органических соединений или смеси изомеров.
V р-ра = V1 + V2
где V1, V2 - объемы первого и второго компонентов до образования раствора.
Неидеальными называются растворы, которые не подчиняются законам идеальных и предельно разбавленных растворов.Для характеристики их равновесных свойств пользуются методом активности (Г. Льюис).
Идеальные растворы подчиняются закону Рауля. Соответственно неидеальными считаются растворы , имеющие отклонения от закона Рауля.
Согласно закону Рауля, парциальное давление каждого компонента в паре пропорционально мольной доле этого компонента в растворе. Например, для низкокипящего компонента А

При этом в качестве коэффициента пропорциональности в уравнении выступает давление насыщенного пара  компонента А при соответствующей температуре.
компонента А при соответствующей температуре.
Согласно закону Дальтона для идеальной газовой смеси, общее давление пара над раствором равно сумме парциальных давлений его компонентов. Для бинарной смеси
 .
.
Для парциальных давлений компонентов можно также записать  ;
;  .
.
В соответствие с законом Рауля и Дальтона общее давление паровой смеси
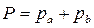 =
= 


 .
.
В реальных растворах закон Рауля не выполняется. Зависимости парциальных давлений компонентов от состава раствора не линейны и выражаются через активности компонентов в растворе аi , зависящие от концентрации и свойств компонентов:
Р1 = Рº1 а1 ; Р2 = Рº2 а2
Наблюдаются положительные и отрицательные отклонения от закона Рауля в реальных растворах. Они обусловлены различными взаимодействиями между однородными и разнородными молекулами в растворе. Если однородные молекулы притягиваются друг к другу сильнее, чем разнородные, то это облегчает переход молекул в газовую фазу и давление повышается.
Примерами таких растворов являются бензол – ацетон, вода - метиловый спирт. Их образование сопровождается поглощением тепла.
Дата добавления: 2015-01-29; просмотров: 1116; Мы поможем в написании вашей работы!; Нарушение авторских прав |