
КАТЕГОРИИ:
АстрономияБиологияГеографияДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРиторикаСоциологияСпортСтроительствоТехнологияФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Условия образования и растворения осадков.
Равновесие, устанавливающееся между осадком малорастворимого вещества и его насыщенным раствором описывается уравнением:
АаВв(т)  АаВв(р)
АаВв(р) 
 .
.
В рассматриваемых ниже случаях речь идет, в основном, о малорастворимых гидроксидах и солях. Эти соединения представляют собой сильные электролиты – та их часть, которая перешла в раствор, практически полностью диссоциирована, а если в растворе содержатся недиссоциированные молекулы  , то их концентрация ничтожна и, кроме того, в насыщенном растворе является величиной постоянной, поэтому рассматриваемое равновесие можно написать в виде
, то их концентрация ничтожна и, кроме того, в насыщенном растворе является величиной постоянной, поэтому рассматриваемое равновесие можно написать в виде
АаВв(т) 
 (43)
(43)
Константа равновесия этого процесса называется произведением растворимости малорастворимого соединения
 (44)
(44)
и при постоянной температуре является величиной постоянной.
Условие образования осадков непосредственно вытекает из выражения (44): если в растворе произведение реальных концентраций ионов  и
и  , рассчитанное по формуле (44), больше, чем произведение растворимости
, рассчитанное по формуле (44), больше, чем произведение растворимости  при данной температуре, то осадок выпадает. Если же произведение меньше численного значения произведения растворимости, то осаждения не происходит.
при данной температуре, то осадок выпадает. Если же произведение меньше численного значения произведения растворимости, то осаждения не происходит.
Равновесие (43) определяет полноту осаждения малорастворимого соединения: чтобы максимально полно вывести его из раствора в осадок, следует увеличивать концентрацию катиона  и (или)
и (или)  аниона
аниона  , добавляя в насыщенный раствор одноименные ионы
, добавляя в насыщенный раствор одноименные ионы  и (или)
и (или)  в виде их растворимых соединений – это так называемый «эффект одноименного иона».
в виде их растворимых соединений – это так называемый «эффект одноименного иона».
Если возникает необходимость растворить осадок  , то следует уменьшать в его насыщенном растворе концентрации соответствующих ионов за счет вовлечения их в различные комплексы, либо путем изменения кислотности среды, либо, наконец, сочетая исходное равновесие (43) с окислительно-восстановительными взаимодействиями. Во всех перечисленных случаях в процесс «осаждение растворение» включаются донорно-акцепторные равновесия, которые могут существенно изменить растворимость соединения
, то следует уменьшать в его насыщенном растворе концентрации соответствующих ионов за счет вовлечения их в различные комплексы, либо путем изменения кислотности среды, либо, наконец, сочетая исходное равновесие (43) с окислительно-восстановительными взаимодействиями. Во всех перечисленных случаях в процесс «осаждение растворение» включаются донорно-акцепторные равновесия, которые могут существенно изменить растворимость соединения  .
.
Вычислить рН 0,1н раствора NH4Cl; 



В насыщенном при данной температуре растворе малорастворимого электролита между кристаллами и раствором устанавливается динамическое равновесие.
При равновесии скорость растворения вещества и скорость его кристаллизации равны, т.е. при равновесии в насыщенном растворе малорастворимого электролита скорости прямого и обратного процессов равны.
Отношение константы скоростей есть константа равновесия, которая называется произведением растворимости.
Другими словами произведение растворимости – это константа гетерогенного равновесия между кристаллами малорастворимого электролита КхАу и его раствором

Например, для насыщенного раствора малорастворимой соли Са3(РО4)2 в отсутствие сильных электролитов

При значительной ионной силе раствора произведение растворимости выражается через активности ионов

Эффективная концентрация ионов называется активностью

 - коэффициент активности
- коэффициент активности
 - функция ионной силы
- функция ионной силы

Если произведение концентраций ионов в степени их стехиометрических коэффициентов равно произведению растворимости, то раствор относится к насыщенным, если это произведение больше произведения растворимости – выпадает осадок, идет кристаллизация, если меньше произведения растворимости – растворение.
Пример: При комнатной температуре в 100 мл насыщенного раствора содержится 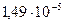 г гидроокиси цинка Zn(OH)2. Определить произведение растворимости гидроокиси цинка.
г гидроокиси цинка Zn(OH)2. Определить произведение растворимости гидроокиси цинка.
Решение
1. Определим растворимость гидроокиси цинка
 г/моль
г/моль
 моль/л
моль/л

 г-ион/л
г-ион/л
 г-ион/л
г-ион/л

Равновесие кристаллизации и растворения электролита подчиняется правилам смещения равновесия. При увеличении в насыщенном растворе концентрации одного из ионов равновесие смещается влево, т.е. в направлении процесса кристаллизации и наоборот, при уменьшении концентрации ионов равновесие смещается в сторону растворения.
Пример:
В условиях предыдущей задачи определить растворимость Zn(OH)2 в 0,001 М растворе ZnCl2


Х 0,001 2х

 моль/л
моль/л
Растворимость Zn(OH)2 в растворе ZnCl2 составляет  моль/л, т.е. растворимость уменьшается в
моль/л, т.е. растворимость уменьшается в  раз.
раз.
Введение в насыщенный раствор малорастворимого электролита другого, хорошо растворимого сильного электролита, не содержащего с ним одноименный ион, приводит к повышению растворимости (солевой эффект).
Повышение ионной силы раствора приводит к увеличению растворимости мало растворимых солей. Так, в морской воде растворимость многих малорастворимых в речной воде веществ заметно возрастает.
Растворимость некоторых слабых оснований может измениться при разных значениях рН , например Zn(OH)2; Al(OH)3 – амфотерные соединения.
В кислых растворах они ведут себя как щелочи, в щелочных – как кислоты.




97.Кислоты и основания, кислотно-основные взаимодействия и равновесия: теории Аррениуса, Брёнстеда – Лоури, Льюиса.
Кисло́ты — химические соединения, способные отдавать катион водорода (кислоты Брёнстеда) либо соединения, способные принимать электронную пару с образованием ковалентной связи (кислоты Льюиса)[1].В быту и технике под кислотами обычно подразумеваются кислоты Брёнстеда, образующие в водных растворах избыток ионов гидроксония H3O+. Присутствие этих ионов обуславливает кислый вкус растворов кислот, способность менять окраску индикаторов и, в высоких концентрациях, раздражающее действие кислот. Подвижные атомы водорода кислот способны замещаться на атомы металлов с образованием солей, содержащих катионы металлов и анионы кислотного остатка.
Основание — это химическое соединение, способное образовывать ковалентную связь с протоном (основание Брёнстеда  ) либо с вакантной орбиталью другого химического соединения (основание Льюиса
) либо с вакантной орбиталью другого химического соединения (основание Льюиса  )[1]. В узком смысле под основаниями понимают осно́вные гидроксиды — сложные вещества, при диссоциации которых в водных растворах отщепляется только один вид анионов — гидроксид-ионы OH-[2].
)[1]. В узком смысле под основаниями понимают осно́вные гидроксиды — сложные вещества, при диссоциации которых в водных растворах отщепляется только один вид анионов — гидроксид-ионы OH-[2].
Кислотно-основные взаимодействия - Окислительно-восстановительные реакции сравнительно редко используются в практике кондуктометрического титрования.
Возможности кондуктометрии здесь несколько сужаются в связи с тем, что реакцию титрования нередко приходится проводить в присутствии большого количества электролитов в сильнокислой среде и т.д. В таких растворах не всегда удается с достаточной точностью определить изменение электрической проводимости, связанное с протеканием реакции титрования.
Известные ограничения накладывает и скорость некоторых реакций окисления-восстановления, не всегда достаточно высокая при обычной температуре. Повышение температуры оказывается малоэффективным, так как становится крайне необходимым термостатирование кондуктометрической ячейки, а существенное увеличение электрической проводимости раствора затрудняет установление точки эквивалентности.
Дата добавления: 2015-01-29; просмотров: 387; Мы поможем в написании вашей работы!; Нарушение авторских прав |