
КАТЕГОРИИ:
АстрономияБиологияГеографияДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРиторикаСоциологияСпортСтроительствоТехнологияФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Скорость большинства реакций увеличивается при увеличении температуры (искл. Ферментативные реакции).
Правило Вант-Гоффа: При повышении температуры на каждые 10 градусов константа скорости гомогенной элементарной реакции увеличивается в два—четыре раза.
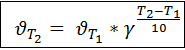 , где
, где 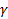 - температурный коэффициент скорости реакции
- температурный коэффициент скорости реакции
 Уравнение Аррениуса: устанавливает зависимость константы скорости химической реакции от температуры.
Уравнение Аррениуса: устанавливает зависимость константы скорости химической реакции от температуры.
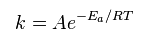 где А- предэкспоненциальный множитель, R – универсальная газовая постоянная (8,314
где А- предэкспоненциальный множитель, R – универсальная газовая постоянная (8,314 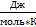 ), T – абсолютная температура.
), T – абсолютная температура.
30. Понятие об активных молекулах:
Для образования новых веществ необходимо, чтобы происходило соударение молекул реагирующих веществ, следовательно, ослабление или разрыв связей между атомами. Но чтобы разорвать или ослабить связь молекулы должны обладать большой энергией. Избыточная энергия, которой должны обладать молекулы для того, чтобы их столкновение могло привести к образованию нового вещества, называется энергией активизации данной реакции (кДж/моль). Молекулы, обладающие такой энергией, называются активными молекулами. С ростом температуры число активных молекул возрастает. Отсюда следует, что скорость реакции должна увеличиваться с повышением температуры.
Активированный комплекс- группировка атомов в решающий момент элементарного акта химической реакции.
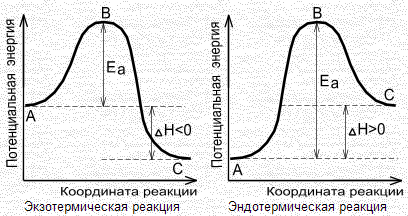 Энергетическая диаграмма:
Энергетическая диаграмма:
А - реагенты, В - активированный комплекс (переходное состояние), С - продукты.
Чем больше энергия активации, тем сильнее возрастает скорость реакции при увеличении температуры.
31. Катализ:
Вещества, которые участвуют в реакциях и увеличивают ее скорость, оставаясь к концу реакции неизменными, называются катализаторами. Механизм действия катализаторов связан с уменьшением энергии активации реакции за счет образования промежуточных соединений. При гомогенном катализе реагенты и катализатор составляют одну фазу (находятся в одном агрегатном состоянии), при гетерогенном катализе - разные фазы (находятся в различных агрегатных состояниях). Резко замедлить протекание нежелательных химических процессов в ряде случаев можно добавляя в реакционную среду ингибиторы (явление "отрицательного катализа").
32. Обратимые реакции - химические реакции, протекающие одновременно в двух противоположных направлениях, а необратимые- в одном напралении.
Химическое равновесие - состояние системы, в котором скорость прямой реакции (V1) равна скорости обратной реакции (V2). При химическом равновесии концентрации веществ остаются неизменными. Химическое равновесие имеет динамический характер: прямая и обратная реакции при равновесии не прекращаются.
Состояние химического равновесия количественно характеризуется константой равновесия, представляющей собой отношение констант прямой (K1) и обратной (K2) реакций.
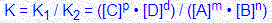 Для реакции mA + nB
Для реакции mA + nB 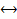 pC + dD константа равновесия равна:
pC + dD константа равновесия равна:
Константа равновесия зависит от температуры и природы реагирующих веществ. Чем больше константа равновесия, тем больше равновесие сдвинуто в сторону образования продуктов прямой реакции. Катализаторы не влияют на положение равновесия.
33. Принцип Ле-Шателье: Если на систему, находящуюся в равновесии, производится внешнее воздействие (изменяются концентрация, температура, давление), то оно благоприятствует протеканию той из двух противоположных реакций, которая ослабляет это воздействие.
Давление. Увеличение давления (для газов) смещает равновесие в сторону реакции, ведущей к уменьшению объема (т.е. к образованию меньшего числа молекул).
Увеличение температуры смещает положение равновесия в сторону эндотермической реакции (т.е. в сторону реакции, протекающей с поглощением теплоты).
Увеличение концентрации исходных веществ и удаление продуктов из сферы реакции смещает равновесие в сторону прямой реакции.
34. Любая химическая реакция сопровождается выделением или поглощением энергии. Чаще всего энергия выделяется или поглощается в виде теплоты (реже - в виде световой или механической энергии). Эту теплоту можно измерить. Результат измерения выражают в килоджоулях (кДж) для одного МОЛЯ реагента или (реже) для моля продукта реакции. Такая величина называется ТЕПЛОВЫМ ЭФФЕКТОМ РЕАКЦИИ.
Энтальпия — это та энергия, которая доступна для преобразования в теплоту при определенном постоянном давлении. Энтальпия или энергия расширенной системы Е равна сумме внутренней энергии газа U и потенциальной энергии поршня с грузом: 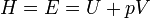
Под стандартной теплотой образования понимают тепловой эффект реакции образования одного моля вещества из простых веществ, его составляющих, находящихся в устойчивых стандартных состояниях. Энтальпия образования простых веществ принимается равной нулю, причем нулевое значение энтальпии образования относится к агрегатному состоянию, устойчивому при T = 298 K.
Стандартная энтальпия сгорания ( 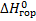 )- тепловой эффект реакции сгорания одного моля вещества в кислороде до образования оксидов в высшей степени окисления. Теплота сгорания негорючих веществ принимается равной нулю.
)- тепловой эффект реакции сгорания одного моля вещества в кислороде до образования оксидов в высшей степени окисления. Теплота сгорания негорючих веществ принимается равной нулю.
Под энтальпией гидратации — понимается теплота, которая выделяется при переходе 1 моля ионов из вакуума в раствор.
Стандартная энтальпия нейтрализации — энтальпия реакции взаимодействия сильных кислот и оснований с образованием 1 моля воды при стандартных условиях. Стандартная энтальпия нейтрализации для концентрированных растворов сильных электролитов зависит от концентрации ионов.
Закон Гесса — основной закон термохимии, который формулируется следующим образом:
Тепловой эффект химической реакции, проводимой в изобарно-изотермических или изохорно-изотермических условиях, зависит только от вида и состояния исходных веществ и продуктов реакции и не зависит от пути её протекания.
Иными словами, количество теплоты, выделяющееся или поглощающееся при каком-либо процессе, всегда одно и то же, независимо от того, протекает ли данное химическое превращение в одну или в несколько стадий (при условии, что температура, давление и агрегатные состояния веществ одинаковы).
Следствия из закона:
· Тепловой эффект прямой реакции равен по величине и противоположен по знаку тепловому эффекту обратной реакции (закон Лавуазье-Лапласа).
· 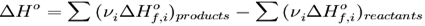 Тепловой эффект химической реакции равен разности сумм теплот образования (ΔHf) продуктов реакции и исходных веществ, умноженных на стехиометрические коэффициенты (ν):
Тепловой эффект химической реакции равен разности сумм теплот образования (ΔHf) продуктов реакции и исходных веществ, умноженных на стехиометрические коэффициенты (ν):
· Тепловой эффект химической реакции равен разности сумм теплот сгорания (ΔHc) исходных веществ и продуктов реакции, умноженных на стехиометрические коэффициенты (ν): 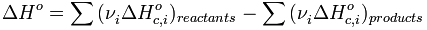
35. Энтропия- в естественных науках мера неупорядоченности системы, состоящей из многих элементов. Понятие энтропии было впервые введено в 1865 году Рудольфом Клаузиусом. Он определил изменение энтропии термодинамической системы при обратимом процессе как отношение общего количества тепла  Q к величине абсолютной температуры T:
Q к величине абсолютной температуры T: 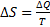 .
.
критерием самопроизвольного протекания химических реакций является отрицательное значение энергии Гиббса: ΔG < 0.
Для экзотермических реакций (ΔH < 0) величина ΔG также, как правило, меньше нуля, поскольку в уравнении ΔG = ΔH - TΔS при ΔS > 0 вычитаемое будет всегда отрицательным, а при ΔS < 0 - положительным, но небольшим по значению вплоть до очень высоких температур, и, следовательно, не превышающим отрицательного значения ΔH.
Для эндотермических реакций (ΔH > 0), имеющих ΔS < 0, их протекание в заданном направлении невозможно ни при какой температуре, т.к. всегда ΔG > 0. Для реакций с ΔS > 0 их протекание возможно, но только при таких высоких температурах, когда вычитаемое (- TΔS) превысит положительное значение энтальпии реакции.
Таким образом, принципиальную возможность протекания химического процесса и его направление можно определить, рассчитав значение ΔG.
По значению стандартной энергии Гиббса реакции можно рассчитать значение константы равновесия K и сделать вывод о положении равновесия. Для рассчета энергии Гиббса реакции необходимо использовать выражение:
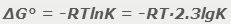 Где R - универсальная газовая постоянная: 8.31441 Дж/(моль·K).
Где R - универсальная газовая постоянная: 8.31441 Дж/(моль·K).
36. Раствор- гомогенная устойчивая система, состоящая из двух и более компонентов и продуктов их взаимодействия. (расвор= растворенное вещество+ растворитель).
Растворитель — компонент, агрегатное состояние которого не изменяется при образовании раствора. В случае же растворов, образующихся при смешении газа с газом, жидкости с жидкостью, твёрдого вещества с твёрдым, растворителем считается компонент, количество которого в растворе преобладает.
Растворение — переход молекул вещества из одной фазы в другую (раствор, растворенное состояние). Происходит в результате взаимодействия атомов (молекул) растворителя и растворённого вещества и сопровождается увеличением энтропии при растворении твёрдых веществ и её уменьшением при растворении газов. При растворении межфазная граница исчезает, при этом многие физические свойства раствора (например, плотность, вязкость, иногда — цвет, и другие) меняются.
В случае химического взаимодействия растворителя и растворённого вещества сильно меняются и химические свойства — например, при растворении газа хлороводорода в воде образуется жидкая соляная кислота.
В зависимости от цели для описания концентрации растворов используются разные физические величины:
Ненасыщенный раствор — раствор, в котором концентрация растворенного вещества меньше, чем в насыщенном растворе, и в котором при данных условиях можно растворить еще некоторое его количество.
Насыщенный раствор — раствор, в котором растворённое вещество при данных условиях достигло максимальной концентрации и больше не растворяется. Осадок данного вещества находится в равновесном состоянии с веществом в растворе.
Пересыщенный раствор — раствор, содержащий при данных условиях больше растворённого вещества, чем в насыщенном растворе, избыток вещества легко выпадает в осадок. Обычно пересыщенный раствор получают охлаждением раствора, насыщенного при более высокой температуре (пересыщение).
Концентрированный раствор — раствор с высоким содержанием растворённого вещества в противоположность разбавленному раствору, содержащему малое количество растворённого вещества. Деление растворов на концентрированные и разбавленные не связано с делением на насыщенные и ненасыщеные. Так насыщенный 0,0000134М раствор хлорида серебра является очень разбавленным, а 4М раствор бромида калия, будучи очень концентрированным, не является насыщенным.
Разбавленный раствор — раствор с низким содержанием растворённого вещества. Отметим, что не всегда разбавленный раствор является ненасыщенным — например, насыщенный 0,0000134М раствор практически нерастворимого хлорида серебра является очень разбавленным. Граница между разбавленным и концентрированным растворами весьма условна.
Согласно второму началу термодинамики при р, Т = = const вещества самопроизвольно могут растворяться в каком-либо растворителе, если в результате этого процесса энергия Гиббса системы уменьшается, т. е.
ΔG = (ΔН – TΔS) < 0.
Величину ΔН называют энтальпийным фактором, а величину TΔS – энтропийным фактором растворения.
При растворении жидких и твердых веществ энтропия системы обычно возрастает (ΔS > 0), так как растворяемые вещества из более упорядоченного состояния переходят в менее упорядоченное. Вклад энтропийного фактора, способствующий увеличению растворимости, особенно заметен при повышенных температурах, потому что в этом случае множитель Т велик и абсолютное значение произведения TΔS также велико, соответственно возрастает убыль энергии Гиббса.
При растворении газов в жидкости энтропия системы обычно уменьшается (ΔS < 0), так как растворяемое вещество из менее упорядоченного состояния (большого объема) переходит в более упорядоченное (малый объем). Снижение температуры благоприятствует растворению газов, потому что в этом случае множитель Т мал и абсолютное значение произведения TΔS будет тем меньше, а убыль энергии Гиббса тем больше, чем ниже значение Т.
В процессе образования раствора энтальпия системы также может как увеличиваться (NaCI), так и уменьшаться (КОН). Изменение энтальпии процесса растворения нужно рассматривать в соответствии с законом Гесса как алгебраическую сумму эндо– и экзотермических вкладов всех процессов, сопровождающих процесс растворения.
Стандартная энтальпия растворения ( 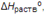 ) —тепловой эффект процесса растворения 1 моля вещества в бесконечно большом количестве растворителя. Складывается из теплоты разрушения кристаллической решетки и теплоты гидратации (или теплоты сольватации для неводных растворов), выделяющейся в результате взаимодействия молекул растворителя с молекулами или ионами растворяемого вещества с образованием соединений переменного состава — гидратов (сольватов). Разрушение кристаллической решетки, как правило, эндотермический процесс — ΔHреш > 0, а гидратация ионов — экзотермический, ΔHгидр < 0.
) —тепловой эффект процесса растворения 1 моля вещества в бесконечно большом количестве растворителя. Складывается из теплоты разрушения кристаллической решетки и теплоты гидратации (или теплоты сольватации для неводных растворов), выделяющейся в результате взаимодействия молекул растворителя с молекулами или ионами растворяемого вещества с образованием соединений переменного состава — гидратов (сольватов). Разрушение кристаллической решетки, как правило, эндотермический процесс — ΔHреш > 0, а гидратация ионов — экзотермический, ΔHгидр < 0.
Моляльность — количество растворённого вещества (число моль) в 1000 г растворителя. Измеряется в молях на кг
Химическая теория растворов Д.И. Менделеева: физическая теория растворов предполагает, что растворенное вещество и растворитель ведут себя безразлично к друг другу, а теория растворов Менделеева предусматривает, что они реагируют друг с другом.
37. Кривые растворимости: это графики, показывающие зависимость растворимости веществ (в воде или в другом растворителе) от температуры (для каждого растворителя - своя кривая, так же, как и для каждого вещества в одном и том же растворителе). Горизонтальная ось - температура (t, oC), вертикальная - растворимость (s, г на 100 г воды).
Зако́н Ге́нри — закон, по которому при постоянной температуре растворимость газа в данной жидкости прямо пропорциональна давлению этого газа над раствором. Закон пригоден лишь для идеальных растворов и невысоких давлений.
Закон Генри записывается обычно следующим образом:
C = kp,
где:
p — парциальное давление газа над раствором,
c — молярная концентрация газа в растворе,
k — коэффициент Генри.
40. Закон разбавления Оствальда — соотношение, выражающее зависимость эквивалентной электропроводности разбавленного раствора бинарного слабого электролита от концентрации раствора:
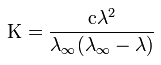 Здесь К — константа диссоциации электролита, с — концентрация, λ и λ∞ — значения эквивалентной электропроводности соответственно при концентрации с и при бесконечном разбавлении.
Здесь К — константа диссоциации электролита, с — концентрация, λ и λ∞ — значения эквивалентной электропроводности соответственно при концентрации с и при бесконечном разбавлении.
Константа диссоциации — вид константы равновесия, которая характеризует склонность объекта диссоциировать (разделяться) обратимым образом на частицы, как например когда комплекс распадается на составляющие молекулы, или когда соль диссоциирует в водном растворе на ионы.
42. Ступенчато диссоциируют чаще всего кислоты , редко основания.
Кислотами называются электролиты, при диссоциации которых в качестве катионов образуются только катионы водорода.
45. Гидролиз солей — разновидность реакций гидролиза, обусловленного протеканием реакций ионного обмена в растворах (преимущественно, водных) растворимых солей-электролитов. Движущей силой процесса является взаимодействие ионов с водой, приводящее к образованию слабого электролита в ионном или (реже) молекулярном виде («связывание ионов»).
46. Условие выпадения осадка только одно: произведение концентраций соответствующих ионов в степенях стехиометрических коэффициентов больше, чем произведение растворимости соли при данной температуре.
48. Гальвани́ческий элеме́нт — химический источник электрического тока, основанный на взаимодействии двух металлов и (или) их оксидов в электролите, приводящем к возникновению в замкнутой цепи электрического тока.
Гальванический элемент – это устройство, в котором на основе ОВР получают электрический ток. Наиболее простой медно-цинковый или элемент Даниэля-Якоби.
Процесс окисления (отдача электронов) на аноде (отрицательный полюс), процесс восстановления (присоединения) электронов – на катоде (положительный полюс)
Причина возникновения электрического тока – разность электродных потенциалов. (э.д.с.)
Гальванические элементы характеризуются: э.д.с., емкостью, энергией, которую он может отдать во внешнюю цепь, сохраняемостью.
Электродвижущая сила (ЭДС) гальванического элемента зависит от материала электродов и состава электролита. ЭДС описывается термодинамическими функциями, протекающих электрохимических процессов, в виде уравнения Нернста.
Ёмкость элемента – это количество электричества, которое источник тока отдает при разряде. Ёмкость зависит от массы запасенных в источнике реагентов и степени их превращения, снижается с понижением температуры или увеличением разрядного тока.
Энергия гальванического элемента численно равна произведению его ёмкости на напряжение. С увеличением количества вещества реагентов в элементе и до определенного предела, с увеличением температуры, энергия возрастает. Энергию уменьшает увеличение разрядного тока.
Сохраняемость – это срок хранения элемента, в течение которого его характеристики остаются в заданных пределах. Сохраняемость элемента уменьшается с ростом температуры хранения.
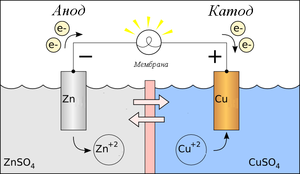
Для всех металлов характерно свойство в большей или меньшей степени растворяться в воде. При этом в воду переходят положительно заряженные ионы металла, в результате чего пластинка (из-за появления в ней избыточных электронов) заряжается отрицательно. Гидратированные катионы металла скапливаются возле поверхности пластинки на границе раздела двух фаз (металл-раствор). Возникает двойной электрический слой, характеризующийся некоторой разностью электростатических потенциалов. Как известно, энергию, которую необходимо затратить (положительный потенциал) или которую можно получить (отрицательный потенциал) при переносе единицы электричества из бесконечности в данную точку, называют электрическим потенциалом.
Разность электрических потенциалов или скачок потенциала на границе металл-раствор электролита называют электродным потенциалом.
Электродный потенциал называется стандартным водородным потенциалом Е02Н+/H2, а его значение принято равным нулю.
50. Электродные потенциалы полуэлементов часто называют окислительно-восстановительными потенциалами. Принято указывать окислительно-восстановительные потенциалы в виде восстановительных потенциалов.
53-55. Комплексное соединение — химическое вещество, в состав которого входят комплексные частицы. В настоящее время строгого определения понятия «комплексная частица» нет. Обычно используется следующее определение.
Комплексная частица — сложная частица, способная к самостоятельному существованию в кристалле или растворе, образованная из других, более простых частиц, также способных к самостоятельному существованию. Иногда комплексными частицами называют сложные химические частицы, все или часть связей в которых образованы по донорно-акцепторному механизму.
Комплексообразователь — центральный атом комплексной частицы. Обычно комплексообразователь — атом элемента, образующего металл, но это может быть и атом кислорода, азота, серы, йода и других элементов, образующих неметаллы. Комплексообразователь обычно положительно заряжен и в таком случае именуется в современной научной литературе металлоцентром; заряд комплексообразователя может быть также отрицательным или равным нулю.
Лиганды (Адденты) — атомы или изолированные группы атомов, располагающиеся вокруг комплексообразователя. Лигандами могут быть частицы, до образования комплексного соединения представлявшие собой молекулы (H2O, CO, NH3 и др.), анионы (OH−, Cl−, PO43− и др.), а также катион водорода H+.
Внутренняя сфера комплексного соединения — центральный атом со связанными с ним лигандами, то есть, собственно, комплексная частица.
Внешняя сфера комплексного соединения — остальные частицы, связанные с комплексной частицей ионной или межмолекулярными связями, включая водородные.
Дентатность лиганда определяется числом координационных мест, занимаемых лигандом в координационной сфере комплексообразователя. Различают монодентатные (унидентатные) лиганды, связанные с центральным атомом через один из своих атомов, то есть одной ковалентной связью, бидентатные (связанные с центральным атомом через два своих атома, то есть, двумя связями), три- , тетрадентатные и т. д.
Координационное число (КЧ) — число связей, образуемых центральным атомом с лигандами. Для комплексных соединений с монодентантными лигандами КЧ равно числу лигандов, а в случае полидентантных лигандов — числу таких лигандов, умноженному на дентатность.
Магнитные свойства:
Среди химических соединений, в том числе комплексных, различают парамагнитные и диамагнитные, по разному взаимодействующие с внешним магнитным полем. Парамагнитные комплексы обладают моментом µ и поэтому при взаимодействии с внешним магнитным полем втягиваются в него. Напротив, диамагнитные комплексы, не имея собственного магнитного момента, выталкиваются из внешнего магнитного поля. Парамагнитные свойства веществ обусловлены наличием в их структуре неспаренных электронов и в случае комплексов объясняются специфическим заполнением электронами энергетических уровней.
| Примеры комплексных соединений различных цветов | ||||||
| FeII | FeIII | CoII | CuII | AlIII | CrIII | |
| Гидратированный ион | [Fe(H2O)6]2+ Бледно-зелёный | [Fe(H2O)6]3+ Жёлто-коричневый | [Co(H2O)6]2+ Розовый | [Cu(H2O)6]2+ Серо-голубой | [Al(H2O)6]3+ Бесцветный | [Cr(H2O)6]3+ Бледно-зелёный |
| OH-, разбавленный раствор | [Fe(H2O)4(OH)2] Светло-зелёный | [Fe(H2O)3(OH)3] Коричневый | [Co(H2O)4(OH)2] Голубой | [Cu(H2O)4(OH)2] Синий | [Al(H2O)3(OH)3] Белый | [Cr(H2O)3(OH)3] Зелёный |
| OH-, концентрированный раствор | [Fe(H2O)4(OH)2] Светло-зелёный | [Fe(H2O)3(OH)3] Коричневый | |[Co(H2O)4(OH)2] Голубой | [Cu(H2O)4(OH)2] Синий | [Al(OH)4]- Бесцветный | [Cr(OH)6]3- Бледно-зелёный |
| NH3, разбавленный раствор | [Fe(H2O)4(OH)2] Светло-зелёный | [Fe(H2O)3(OH)3] Коричневый | [Co(H2O)4(OH)2] Голубой | [Cu(H2O)4(OH)2] Синий | [Al(H2O)3(OH)3] Белый | [Cr(H2O)3(OH)3] Зелёный |
| NH3, концентрированный раствор | [Fe(H2O)4(OH)2] Светло-зелёный | [Fe(H2O)3(OH)3] Коричневый | [Co(NH3)6]2+ Жёлтый | [Cu(NH3)4(H2O)2]2+| Темно-синий | [Al(H2O)3(OH)3] Белый | [Cr(NH3)6]3+ Бледно-зелёный |
| CO32- | FeCO3 Светло-зелёный | [Fe(H2O)3(OH)3] Коричневый | CoCO3 Розовый | CuCO3 Голубой |
Дата добавления: 2015-04-18; просмотров: 445; Мы поможем в написании вашей работы!; Нарушение авторских прав |
| <== предыдущая лекция | | | следующая лекция ==> |
| Законодательный акт — особый вид исторического источника. | | | Понятие и виды общения |