
КАТЕГОРИИ:
АстрономияБиологияГеографияДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРиторикаСоциологияСпортСтроительствоТехнологияФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Значение уравнения Вукаловича-Новикова для расчета термодинамических параметров воды и водяного пара.
К реальным газам в технической термодинамике принято относить перегретые пары некоторых жидкостей. В отличие от воображаемого идеального газа реальный газ при соответствующих условиях может быть снижен, т.е. сконденсирован, или же переведен в твердое состояние. В технике широко применяют пары различных веществ: воды, аммиака, хлористого метила и др. Наибольшее применение имеет водяной пар, являющийся рабочим телом паровых двигателей, отопительных и других устройств. Будем рассматривать только водяной пар и влажный воздух.
Молекулы реального газа в действительности имеют конечные, хотя и очень малые, геометрические размеры, и соответственно взаимно притягиваются или отталкиваются с силами тем большими, чем меньше среднее расстояние между молекулами (r) (рис.1.) 
Рис. 1. – функциональная зависимость u (потенциальной энергии) от расстояния r между молекулами. Силы взаимного притяжения препятствуют разлетанию молекул газа и, следовательно, действуют в том же направлении, что и внешнее давление P, удерживающее газ в данном объеме. Чтобы учесть действие этих сил, необходимо к внешнему давлению P прибавить некоторый добавочный член, который называется внутренним или молекулярным давлением (рмол): рмол ~ ρ2; ρ = 1/v.
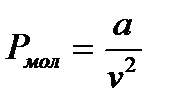 , а – некоторый коэф-т.
, а – некоторый коэф-т.
Из ряда уравнений состояния, применимых для водяного пара с известной степенью приближенности, можно отметить уравнение Ван-дер-Ваальса, составленное для реальных газов и имеющее вид:
 ,
,
b учитывает собственный объем молекул реального газа: a и b – константы, зависящие от природы вещества.
 ;
;  .
.
Рк – критическое давление данного вещества;
Тк – абсолютная критическая температура вещества.
Критическая температура и критическое давление имеют простой физический смысл: взаимное превращение жидкой и газообразной фаз возможно при давлении, меньше критического, и температуре, меньше критической (Р < Рк; Т < Тк).
Параметры Рк ,Тк , vk представляют собой значение параметров в критической точке вещества, является важными термодинамическими характеристиками вещества, выражающими в обобщенной форме эффект действия молекулярных сил.
Уравнение Ван-дер-Ваальса является уравнением третьей степени относительно объема v и поэтому имеет три корня: все действительные (при низких температурах) или один действительный и два комплексных (при сравнительно высоких температурах). Изотермы, построенные по уравнению Ван-дер-Ваальса,изображены на (рис. 2)  Участок изотермы справа от точки а соответствует ненасыщенному (перегретому) пару, а участок слева от точки е — жидкости, участки ab и ed — пересыщенному пару и перегретой жидкости, участок bd отвечает неустойчивым состояниям вещества.
Участок изотермы справа от точки а соответствует ненасыщенному (перегретому) пару, а участок слева от точки е — жидкости, участки ab и ed — пересыщенному пару и перегретой жидкости, участок bd отвечает неустойчивым состояниям вещества.
С ростом температуры протяженность волнообразного участка изотерм уменьшается и, следовательно, точки минимума и максимума, а также точка пересечения каждой из изотерм с горизонтальной прямой сближаются. При некоторой температуре волнообразная часть изотермы укорачивается до нуля, а точки минимума и максимума сливаются в одну точку. В этой точке все три корня Ван-дер-Ваальса уравнения имеют одинаковое значение.
Практически пользоваться уравнением Ван-дер-Ваальса нельзя, так как оно дает результаты, недостаточно точные для нужд современной теплотехники. Наиболее точным является в настоящее время уравнение состояния реальных газов, разработанное М. П. Вукаловичем и Н. И. Новиковым применительно в основном к водяному пару. Вывод этого уравнения основан на предположении наличия в реальных газах ассоциаций молекул, механически объединенных в двойные, тройные и более сложные комплексы, образующиеся в результате взаимодействия между ними. Уравнение Вукаловича-Новикова: 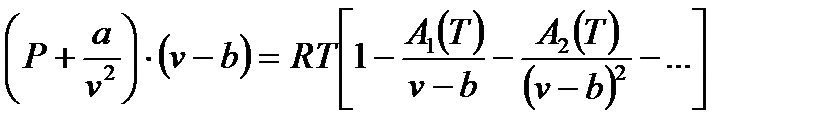 ,
,
А1(Т), А2(Т),… - известные функции температуры.
Для этого уравнения характерно близкое совпадение результатов расчетов с опытными данными. Однако для практических целей пользование этим, как и другими уравнениями состояния реального газа, неудобно вследствие сложности их и необходимости выполнения трудоемких вычислений. Обычно пользуются готовыми данными, которые берут из таблиц водяного пара или из h-s диаграммы водяного пара.
Для правильного представления о процессах изменения состояния пара рассмотрению способов пользования табличными данными необходимо предпослать рассмотрение процесса парообразования и отдельных процессов изменения состояния воды и водяного пара.
Водяной пар получают в паровых котлах, различных по конструкции и производительности. Процесс парообразования в котлах обычно происходит при постоянном давлении, т.е. при p = const.
Рассмотрим особенности процесса парообразования. Предположим, что 1 кг воды при температуре 0°С находится в цилиндрическом сосуде с поршнем, на который действует груз, обусловливающий давление p1 (рис. 3.)  Начнем постепенно, сохраняя неизменным давление р1, нагревать воду, не снимая с нее поршня и груза. Температура ее при этом будет повышаться, а объем незначительно возрастать. При некоторой температуре tн1 (температура кипения) вода закипит. Обозначим занимаемый ею при этом объем через v1.Если бы на поверхность нагреваемой воды положить поршень с другим грузом, то она закипела бы при иной температуре, которая оставалась бы неизменной, пока не выкипела бы вся вода. Из сказанного следует, что данному давлению соответствует единственная и вполне определенная температура кипения воды.
Начнем постепенно, сохраняя неизменным давление р1, нагревать воду, не снимая с нее поршня и груза. Температура ее при этом будет повышаться, а объем незначительно возрастать. При некоторой температуре tн1 (температура кипения) вода закипит. Обозначим занимаемый ею при этом объем через v1.Если бы на поверхность нагреваемой воды положить поршень с другим грузом, то она закипела бы при иной температуре, которая оставалась бы неизменной, пока не выкипела бы вся вода. Из сказанного следует, что данному давлению соответствует единственная и вполне определенная температура кипения воды.
Дальнейшее сообщение тепла не повышает температуру кипящей воды, однако оно вызывает постепенное превращение воды в пар до тех пор, пока вся вода не испарится и в сосуде не останется один пар. Таким образом, в начале процесса парообразования имеется только жидкость, в конце — только пар, а в течение процесса рабочее тело находится в двух агрегатных состояниях — часть находится в жидком состоянии, а часть — в состоянии пара.
Начало процесса кипения – объем v’1; состояние пара – v1’’.
Обе фазы — жидкая и газообразная — в каждый данный момент находятся во взаимном равновесии. Это означает, что жидкой фазой поглощается такое же количество подлетающих к ней молекул газообразной фазы, какое переходит из жидкой фазы в газообразную.
Пар, находящийся в равновесии с жидкостью, из которой он образуется, называют насыщенным паром; если он не содержит жидкой фазы, его называют сухим насыщенным; если же он содержит в себе и жидкую фазу в виде мелкодисперсных частиц, то его называют влажным насыщенным и просто насыщенным паром.
Процесс парообразования сопровождается существенным увеличением объема, занимаемого рабочим телом, и неизменностью температуры и давления. Следовательно, процесс парообразования является одновременно изобарным и изотермическим.
Для практических целей пользование уравнением Вукаловича-Новикова неудобно вследствие сложности их и необходимости выполнения трудоемких вычислений. Обычно пользуются готовыми данными, которые берут из таблиц воды и водяного пара, которые созданы на основании этого уравнения. По таблицам можно определять значения удельных объемов, энтальпии, энтропии и других величин, характеризующих состояние воды и водяного пара, где эти значения даются для большого диапазона давлений и температур. Таблицы составляют для кипящей воды и сухого насыщенного пара и для некипящей воды и перегретого пара. Для кипящей воды и сухого насыщенного пара в зависимости от постановки задачи приходится либо по температуре находить их давления и все прочие величины, либо по давлению находить температуру и все остальные величины.
Дата добавления: 2015-04-18; просмотров: 193; Мы поможем в написании вашей работы!; Нарушение авторских прав |