
КАТЕГОРИИ:
АстрономияБиологияГеографияДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРиторикаСоциологияСпортСтроительствоТехнологияФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
|
Дополнительный список – 2006 год
№ 1 При нагревании белков до 70 градусов, большинство из них теряет свою биологическую активность. Объясните, как связана структура белков с их функцией, что происходит с белком при нагревании? Какие еще факторы могут нарушить структуру и функцию белков? Укажите механизмы защиты структуры белков в клетках. При ответе представьте соответствующие графики и рисунки.
ДНК à Первичная структура белка à Вторичная структура белка à Третичная структура белка à Образование уникальной формы активного центра à Избирательное связывание лигандов à Специфическая функция белка
При нагревании происходит денатурация:
Денатурация белков— это разрушение их нативной конформации, вызванное разрывом слабых связей, стабилизирующих пространственные структуры, при действии денатурирующих агентов. Денатурация сопровождается потерей биологической активности белка.
Денатурацию белков вызывают факторы, способствующие разрыву гидрофобных, водородных и ионных связей, стабилизирующих конформацию белков:
• высокая температура (более 50 "С)
• интенсивное встряхивание раствора
• органические вещества (например, этиловый спирт, фенол и его производные). Для денатурации белков в биохимических исследованиях часто используют мочевину или гуанидинхлорид. Происходит разрыв связей, участвующих в формировании вторичной и третичной структуры нативных белков, и образование новых связей с химическими реагентами;
 • кислоты и щелочи, изменяют рН среды.
• соли тяжёлых металлов (такие как медь, ртуть, серебро, свинец и др.)
• детергенты – вещества, содержащие гидрофобный углеводородный радикал и гидрофильную функциональную группу (такие вещества называют амфифильными).
Удаление денатурирующих агентов диализом приводит к восстановлению конформации и функции белка, т.е. к ренативации.
Молекулярные шапероны предотвращаютденатурацию белков.
В клетках имеются белки – молекулярные шапероны,которые обладают способностью связываться с частично денатурированными, находящимися в неустойчивом, склонном к агрегации состоянии белками и восстанавливать их нативную конформацию.
Вначале эти белки были обнаружены как белкитеплового шока,так как их синтез усиливался при стрессовых воздействиях на клетку, например при повышении температуры (индуцибельные шапероны), но существуют также и конститутивные шапероны, высокий базальный синтез которых не зависит от стрессовых условий.
Шапероны (Ш) классифицируются по массе субъединиц. Разлияают 6 классов:
· Высокомолекулярные (100-110 кД)
· Ш-90 (83-90 кД)
· Ш-70 (60-78 кД)
· Ш-60
· Ш-40
· Низкомолекулярные (15-30 кД)
• кислоты и щелочи, изменяют рН среды.
• соли тяжёлых металлов (такие как медь, ртуть, серебро, свинец и др.)
• детергенты – вещества, содержащие гидрофобный углеводородный радикал и гидрофильную функциональную группу (такие вещества называют амфифильными).
Удаление денатурирующих агентов диализом приводит к восстановлению конформации и функции белка, т.е. к ренативации.
Молекулярные шапероны предотвращаютденатурацию белков.
В клетках имеются белки – молекулярные шапероны,которые обладают способностью связываться с частично денатурированными, находящимися в неустойчивом, склонном к агрегации состоянии белками и восстанавливать их нативную конформацию.
Вначале эти белки были обнаружены как белкитеплового шока,так как их синтез усиливался при стрессовых воздействиях на клетку, например при повышении температуры (индуцибельные шапероны), но существуют также и конститутивные шапероны, высокий базальный синтез которых не зависит от стрессовых условий.
Шапероны (Ш) классифицируются по массе субъединиц. Разлияают 6 классов:
· Высокомолекулярные (100-110 кД)
· Ш-90 (83-90 кД)
· Ш-70 (60-78 кД)
· Ш-60
· Ш-40
· Низкомолекулярные (15-30 кД)
 Ш-70 способны защищать белки от температурной инактивации и восстанавливать конформацию и активность частично денатурированных белков.
Различные семейства шаперонов, обнаруженные практически во всех отделах клетки, участвуют в таких фундаментальных процессах, как:
1) ренативация частично денатурированных белков;
2) узнавание денатурированных белков и транспорт их в лизосомы;
3) синтез белков;
4) формирование трехмерной структуры белков;
5) сборка олигомерных белков;
6) транспорт белков через мембраны;
7) функционирование белковых комплексов и контроль за изменением между активной и неактивной конформацией. Ш-70 способны защищать белки от температурной инактивации и восстанавливать конформацию и активность частично денатурированных белков.
Различные семейства шаперонов, обнаруженные практически во всех отделах клетки, участвуют в таких фундаментальных процессах, как:
1) ренативация частично денатурированных белков;
2) узнавание денатурированных белков и транспорт их в лизосомы;
3) синтез белков;
4) формирование трехмерной структуры белков;
5) сборка олигомерных белков;
6) транспорт белков через мембраны;
7) функционирование белковых комплексов и контроль за изменением между активной и неактивной конформацией.
| № 2 В популяции людей найдены около 300 полиморфных форм гемоглобина. Каковы причины и последствия полиморфизма гемоглобина? Для ответа на вопрос:
а) Расскажите строение основного белка эритроцитов;
б) Объясните, какие изменения в структуре гемоглобина могут привести к образованию полиморфных форм этого белка;
в) Используя в качестве примеров HbS и HbC, объясните, как изменение структуры 6елка отразится на его функции.
Амплификация генов, независимые мутации в копиях и рекомбинации приводят к дивергенции (расхождению) свойств соответствующих белков. Результатом этих процессов является усложнение генома в филогенезе и образование семейств родственных белков с близкой аминокислотной последовательностью и функциями или полиморфные разновидности одного и того же белка.Каждый индивидуум может иметь только два варианта любого белка, тогда как в популяции число вариантов может быть огромно (так, по всем аллелям НЬА популяция людей образует более 600 генетически различающихся групп). Полиморфизм белков настолько велик, что можно говорить о биохимической индивидуальности каждого человека.
а) Основным гемоглобином у человека является HbA. Он состоит из 4-х протомеров (2α2β), каждый из которых в свою очередь состоит из 8 полипептидных спиралей, свернутых в плотную глобулярную структуру, содержащую внутренне гидрофобное ядро и «карман» для связывания гема. В активном центре между Гис E7 и Гис F8 присоединяется гем.
б) 2α2β à 2α2δ à HbA2
HbA + глюкоза à HbA1c
2α2β à 2α2γ à HbF (фетальный)
2α2β à 2ξ2ε à HbE (эмбриональный)
В β-цепи в 6-м положении Глу (полярн) à Вал (гидрофобн) à HbS
В α- или β-цепи Гис E7 или Гис F8 à Тир à Fe 2+ окисляется в Fe3+ à HbM (метгемоглобин)
Фен D1 (гидрофобн) à Сер (гидрофильн) à Hb Хаммерсмита
Гли B6 à Арг à Hb Ривердейла-Бронкса
Асп G1 à Асн à Hb Кемпси
в) В молекуле гемоглобина S (так назван аномальный гемоглобин) мутантными оказались β-цепи, в которых глутамат, высокополярная отрицательно заряженная аминокислота в положении 6 была заменена валином, содержащим гидрофобный радикал.
 В дезоксигемоглобине S имеется участок, комплементарный другому участку таких же молекул, содержащему изменённую аминокислоту. В результате молекулы дезоксигемоглобина начинают «слипаться», образуя удлинённые фибриллярные агрегаты, деформирующие эритроцит и приводящие к образованию аномальных эритроцитов в виде серпа.
В оксигемоглобине S комплементарный участок «замаскирован» в результате изменения конформации белка. Недоступность участка препятствует соединению молекул оксигемоглобина 8 друг с другом. Следовательно, образованию агрегатов HbS способствуют условия, повышающие концентрацию дезоксигемоглобина в клетках (физическая работа, гипоксия, уменьшение pH, условия высокогорья, полёт на самолёте).
Так как «серповидные» эритроциты плохо проходят через капилляры тканей, они часто закупоривают сосуды и создают тем самым локальную гипоксию. Это повышает концентрацию дезоксигемоглобина S в эритроцитах, скорость образования агрегатов гемоглобина S и ещё большую деформацию эритроцитов. Нарушение доставки О2 в ткани вызывает боли и даже некроз клеток в данной области.
Серповидно-клеточная анемия – гомозиготное рецессивное заболевание; проявляется только в том случае, когда от обоих родителей наследуются 2 мутантных гена β-цепей глобина: После рождения ребёнка болезнь не проявляется до тех пор, пока значительные количества HbF не заместятся на HbS. У больных выявляют клинические симптомы, характерные для анемии: головокружение и головные боли, одышка, учащённое сердцебиение, боли в конечностях, повышенную восприимчивость к инфекционным заболеваниям.
Гетерозиготные индивидуумы, имеющие один нормальный ген HbA, а другой ген HbS, в крови имеют лишь следовые количества серповидных клеток и нормальную продолжительность жизни; клинические симптомы болезни у них обычно не проявляются.
HbC, мутация происходит в β-цепи в 6 положении, Глу меняется на Лиз.
В дезоксигемоглобине S имеется участок, комплементарный другому участку таких же молекул, содержащему изменённую аминокислоту. В результате молекулы дезоксигемоглобина начинают «слипаться», образуя удлинённые фибриллярные агрегаты, деформирующие эритроцит и приводящие к образованию аномальных эритроцитов в виде серпа.
В оксигемоглобине S комплементарный участок «замаскирован» в результате изменения конформации белка. Недоступность участка препятствует соединению молекул оксигемоглобина 8 друг с другом. Следовательно, образованию агрегатов HbS способствуют условия, повышающие концентрацию дезоксигемоглобина в клетках (физическая работа, гипоксия, уменьшение pH, условия высокогорья, полёт на самолёте).
Так как «серповидные» эритроциты плохо проходят через капилляры тканей, они часто закупоривают сосуды и создают тем самым локальную гипоксию. Это повышает концентрацию дезоксигемоглобина S в эритроцитах, скорость образования агрегатов гемоглобина S и ещё большую деформацию эритроцитов. Нарушение доставки О2 в ткани вызывает боли и даже некроз клеток в данной области.
Серповидно-клеточная анемия – гомозиготное рецессивное заболевание; проявляется только в том случае, когда от обоих родителей наследуются 2 мутантных гена β-цепей глобина: После рождения ребёнка болезнь не проявляется до тех пор, пока значительные количества HbF не заместятся на HbS. У больных выявляют клинические симптомы, характерные для анемии: головокружение и головные боли, одышка, учащённое сердцебиение, боли в конечностях, повышенную восприимчивость к инфекционным заболеваниям.
Гетерозиготные индивидуумы, имеющие один нормальный ген HbA, а другой ген HbS, в крови имеют лишь следовые количества серповидных клеток и нормальную продолжительность жизни; клинические симптомы болезни у них обычно не проявляются.
HbC, мутация происходит в β-цепи в 6 положении, Глу меняется на Лиз.
| № 3 HbS имеет информацию, отличную от информации НbА и хуже выполняет свою функцию. На примере этих белков объясните связь между первичной структурой и функцией белков. Приведите различные примеры проявления полиморфизма белков.
ДНК à Первичная структура белка à Вторичная структура белка à Третичная структура белка à Образование уникальной формы активного центра à Избирательное связывание лигандов à Специфическая функция белка.
Основным гемоглобином у человека является HbA. Он состоит из 4-х протомеров (2α2β), каждый из которых в свою очередь состоит из 8 полипептидных спиралей, свернутых в плотную глобулярную структуру, содержащую внутренне гидрофобное ядро и «карман» для связывания гема. В активном центре между Гис E7 и Гис F8 присоединяется гем.
В молекуле гемоглобина S (так назван аномальный гемоглобин) мутантными оказались β-цепи, в которых глутамат, высокополярная отрицательно заряженная аминокислота в положении 6 была заменена валином, содержащим гидрофобный радикал.
 В дезоксигемоглобине S имеется участок, комплементарный другому участку таких же молекул, содержащему изменённую аминокислоту. В результате молекулы дезоксигемоглобина начинают «слипаться», образуя удлинённые фибриллярные агрегаты, деформирующие эритроцит и приводящие к образованию аномальных эритроцитов в виде серпа.
В оксигемоглобине S комплементарный участок «замаскирован» в результате изменения конформации белка. Недоступность участка препятствует соединению молекул оксигемоглобина 8 друг с другом. Следовательно, образованию агрегатов HbS способствуют условия, повышающие концентрацию дезоксигемоглобина в клетках (физическая работа, гипоксия, уменьшение pH, условия высокогорья, полёт на самолёте).
Так как «серповидные» эритроциты плохо проходят через капилляры тканей, они часто закупоривают сосуды и создают тем самым локальную гипоксию. Это повышает концентрацию дезоксигемоглобина S в эритроцитах, скорость образования агрегатов гемоглобина S и ещё большую деформацию эритроцитов. Нарушение доставки О2 в ткани вызывает боли и даже некроз клеток в данной области.
Полиморфизм белков.
Амплификация генов, независимые мутации в копиях и рекомбинации приводят к дивергенции (расхождению) свойств соответствующих белков. Результатом этих процессов является усложнение генома в филогенезе и образование семейств родственных белков с близкой аминокислотной последовательностью и функциями или полиморфные разновидности одного и того же белка.
Другой важный пример полиморфизма белков, связанный с проблемой переливания крови, – существование в популяции людей 3 аллельных вариантов гена фермента гликозилтрансферазы (А, В и 0).
В дезоксигемоглобине S имеется участок, комплементарный другому участку таких же молекул, содержащему изменённую аминокислоту. В результате молекулы дезоксигемоглобина начинают «слипаться», образуя удлинённые фибриллярные агрегаты, деформирующие эритроцит и приводящие к образованию аномальных эритроцитов в виде серпа.
В оксигемоглобине S комплементарный участок «замаскирован» в результате изменения конформации белка. Недоступность участка препятствует соединению молекул оксигемоглобина 8 друг с другом. Следовательно, образованию агрегатов HbS способствуют условия, повышающие концентрацию дезоксигемоглобина в клетках (физическая работа, гипоксия, уменьшение pH, условия высокогорья, полёт на самолёте).
Так как «серповидные» эритроциты плохо проходят через капилляры тканей, они часто закупоривают сосуды и создают тем самым локальную гипоксию. Это повышает концентрацию дезоксигемоглобина S в эритроцитах, скорость образования агрегатов гемоглобина S и ещё большую деформацию эритроцитов. Нарушение доставки О2 в ткани вызывает боли и даже некроз клеток в данной области.
Полиморфизм белков.
Амплификация генов, независимые мутации в копиях и рекомбинации приводят к дивергенции (расхождению) свойств соответствующих белков. Результатом этих процессов является усложнение генома в филогенезе и образование семейств родственных белков с близкой аминокислотной последовательностью и функциями или полиморфные разновидности одного и того же белка.
Другой важный пример полиморфизма белков, связанный с проблемой переливания крови, – существование в популяции людей 3 аллельных вариантов гена фермента гликозилтрансферазы (А, В и 0).
| | № 6 В 1949 году Лайнус Полинг с сотрудниками доказали, что в основе заболевания серповидноклеточной анемией лежит изменение первичной структуры белка. Назовите этот белок и на его примере расскажите о зависимости конформации белков и их функций от первичной структуры. Приведите примеры других заболеваний, основой которых является изменение структуры белков.
Серповидно-клеточная анемия – гомозиготное рецессивное заболевание; проявляется только в том случае, когда от обоих родителей наследуются 2 мутантных гена β-цепей глобина: После рождения ребёнка болезнь не проявляется до тех пор, пока значительные количества HbF не заместятся на HbS. У больных выявляют клинические симптомы, характерные для анемии: головокружение и головные боли, одышка, учащённое сердцебиение, боли в конечностях, повышенную восприимчивость к инфекционным заболеваниям.
Гетерозиготные индивидуумы, имеющие один нормальный ген HbA, а другой ген HbS, в крови имеют лишь следовые количества серповидных клеток и нормальную продолжительность жизни; клинические симптомы болезни у них обычно не проявляются.
В молекуле гемоглобина S (так назван аномальный гемоглобин) мутантными оказались β-цепи, в которых глутамат, высокополярная отрицательно заряженная аминокислота в положении 6 была заменена валином, содержащим гидрофобный радикал.
 В дезоксигемоглобине S имеется участок, комплементарный другому участку таких же молекул, содержащему изменённую аминокислоту. В результате молекулы дезоксигемоглобина начинают «слипаться», образуя удлинённые фибриллярные агрегаты, деформирующие эритроцит и приводящие к образованию аномальных эритроцитов в виде серпа.
В оксигемоглобине S комплементарный участок «замаскирован» в результате изменения конформации белка. Недоступность участка препятствует соединению молекул оксигемоглобина 8 друг с другом. Следовательно, образованию агрегатов HbS способствуют условия, повышающие концентрацию дезоксигемоглобина в клетках (физическая работа, гипоксия, уменьшение pH, условия высокогорья, полёт на самолёте).
Так как «серповидные» эритроциты плохо проходят через капилляры тканей, они часто закупоривают сосуды и создают тем самым локальную гипоксию. Это повышает концентрацию дезоксигемоглобина S в эритроцитах, скорость образования агрегатов гемоглобина S и ещё большую деформацию эритроцитов. Нарушение доставки О2 в ткани вызывает боли и даже некроз клеток в данной области.
ДНК à Первичная структура белка à Вторичная структура белка à Третичная структура белка à Образование уникальной формы активного центра à Избирательное связывание лигандов à Специфическая функция белка
Другие заболевания:
α-Талассемиивозникают при нарушении синтеза α-цепей. В геноме каждого индивидуума существует 4 копии гена α-глобина (по 2 копии на каждой хромосоме), поэтому встречаются несколько видов недостаточности α -цепей. Если дефектна одна из 4 копий, то фенотипически это не проявляется, и такого человека рассматривают как «молчащего носителя» талассемии. При дефекте в 2 копиях гена у носителя мутации обнаруживают слабовыраженные признаки болезни, а при дефекте в 3 копиях развивается гемолитическая анемия. При полном отсутствии синтеза α -цепей (т.е. дефектны все 4 копии гена) наступает внутриутробная гибель плода, так как не образуются фетальные формы Hb, а тетрамеры γ 4 обладают высоким сродством к кислороду и не способны функционировать как транспортные белки.
β-Талассемииразвиваются в результате снижения синтеза β-цепей Hb, для которых на каждой хромосоме имеется по одному гену. Синтез HbA начинается после рождения ребёнка. При дефекте в одной из копий гена недостаточность Hb проявляется в слабой степени и не требует специального лечения. Однако при полном включении синтеза β-цепей развивается тяжёлая форма анемии, и таким пациентам провод либо периодическую трансфузию крови, либо пересадку костного мозга.
В дезоксигемоглобине S имеется участок, комплементарный другому участку таких же молекул, содержащему изменённую аминокислоту. В результате молекулы дезоксигемоглобина начинают «слипаться», образуя удлинённые фибриллярные агрегаты, деформирующие эритроцит и приводящие к образованию аномальных эритроцитов в виде серпа.
В оксигемоглобине S комплементарный участок «замаскирован» в результате изменения конформации белка. Недоступность участка препятствует соединению молекул оксигемоглобина 8 друг с другом. Следовательно, образованию агрегатов HbS способствуют условия, повышающие концентрацию дезоксигемоглобина в клетках (физическая работа, гипоксия, уменьшение pH, условия высокогорья, полёт на самолёте).
Так как «серповидные» эритроциты плохо проходят через капилляры тканей, они часто закупоривают сосуды и создают тем самым локальную гипоксию. Это повышает концентрацию дезоксигемоглобина S в эритроцитах, скорость образования агрегатов гемоглобина S и ещё большую деформацию эритроцитов. Нарушение доставки О2 в ткани вызывает боли и даже некроз клеток в данной области.
ДНК à Первичная структура белка à Вторичная структура белка à Третичная структура белка à Образование уникальной формы активного центра à Избирательное связывание лигандов à Специфическая функция белка
Другие заболевания:
α-Талассемиивозникают при нарушении синтеза α-цепей. В геноме каждого индивидуума существует 4 копии гена α-глобина (по 2 копии на каждой хромосоме), поэтому встречаются несколько видов недостаточности α -цепей. Если дефектна одна из 4 копий, то фенотипически это не проявляется, и такого человека рассматривают как «молчащего носителя» талассемии. При дефекте в 2 копиях гена у носителя мутации обнаруживают слабовыраженные признаки болезни, а при дефекте в 3 копиях развивается гемолитическая анемия. При полном отсутствии синтеза α -цепей (т.е. дефектны все 4 копии гена) наступает внутриутробная гибель плода, так как не образуются фетальные формы Hb, а тетрамеры γ 4 обладают высоким сродством к кислороду и не способны функционировать как транспортные белки.
β-Талассемииразвиваются в результате снижения синтеза β-цепей Hb, для которых на каждой хромосоме имеется по одному гену. Синтез HbA начинается после рождения ребёнка. При дефекте в одной из копий гена недостаточность Hb проявляется в слабой степени и не требует специального лечения. Однако при полном включении синтеза β-цепей развивается тяжёлая форма анемии, и таким пациентам провод либо периодическую трансфузию крови, либо пересадку костного мозга.
| | № 4 В крови студента одной из африканских стран, поступившего в больницу с жалобами на одышку, головокружение, учащенное сердцебиение и боли в конечностях, при анализе крови были обнаружены эритроциты, имеющие форму серпа. Какова причина развития данного заболевания? Для ответа на вопрос:
а) Опишите строение основного белка эритроцитов и объясните, какие изменения в структуре привели к образованию патологической формы этого белка;
б) Используя таблицу генетического кода, определите, могут ли эти изменения быть результатом точечных мутаций;
в) Объясните, почему изменяется форма и функция эритроцитов.
а), в)Основным гемоглобином у человека является HbA. Он состоит из 4-х протомеров (2α2β), каждый из которых в свою очередь состоит из 8 полипептидных спиралей, свернутых в плотную глобулярную структуру, содержащую внутренне гидрофобное ядро и «карман» для связывания гема. В активном центре между Гис E7 и Гис F8 присоединяется гем.
В молекуле гемоглобина S (так назван аномальный гемоглобин) мутантными оказались β-цепи, в которых глутамат, высокополярная отрицательно заряженная аминокислота в положении 6 была заменена валином, содержащим гидрофобный радикал.
 В дезоксигемоглобине S имеется участок, комплементарный другому участку таких же молекул, содержащему изменённую аминокислоту. В результате молекулы дезоксигемоглобина начинают «слипаться», образуя удлинённые фибриллярные агрегаты, деформирующие эритроцит и приводящие к образованию аномальных эритроцитов в виде серпа.
В оксигемоглобине S комплементарный участок «замаскирован» в результате изменения конформации белка. Недоступность участка препятствует соединению молекул оксигемоглобина 8 друг с другом. Следовательно, образованию агрегатов HbS способствуют условия, повышающие концентрацию дезоксигемоглобина в клетках (физическая работа, гипоксия, уменьшение pH, условия высокогорья, полёт на самолёте).
Так как «серповидные» эритроциты плохо проходят через капилляры тканей, они часто закупоривают сосуды и создают тем самым локальную гипоксию. Это повышает концентрацию дезоксигемоглобина S в эритроцитах, скорость образования агрегатов гемоглобина S и ещё большую деформацию эритроцитов. Нарушение доставки О2 в ткани вызывает боли и даже некроз клеток в данной области.
Серповидно-клеточная анемия – гомозиготное рецессивное заболевание; проявляется только в том случае, когда от обоих родителей наследуются 2 мутантных гена β-цепей глобина: После рождения ребёнка болезнь не проявляется до тех пор, пока значительные количества HbF не заместятся на HbS. У больных выявляют клинические симптомы, характерные для анемии: головокружение и головные боли, одышка, учащённое сердцебиение, боли в конечностях, повышенную восприимчивость к инфекционным заболеваниям.
Гетерозиготные индивидуумы, имеющие один нормальный ген HbA, а другой ген HbS, в крови имеют лишь следовые количества серповидных клеток и нормальную продолжительность жизни; клинические симптомы болезни у них обычно не проявляются.
б)Эти изменения могут быть результатом точечных мутаций
В дезоксигемоглобине S имеется участок, комплементарный другому участку таких же молекул, содержащему изменённую аминокислоту. В результате молекулы дезоксигемоглобина начинают «слипаться», образуя удлинённые фибриллярные агрегаты, деформирующие эритроцит и приводящие к образованию аномальных эритроцитов в виде серпа.
В оксигемоглобине S комплементарный участок «замаскирован» в результате изменения конформации белка. Недоступность участка препятствует соединению молекул оксигемоглобина 8 друг с другом. Следовательно, образованию агрегатов HbS способствуют условия, повышающие концентрацию дезоксигемоглобина в клетках (физическая работа, гипоксия, уменьшение pH, условия высокогорья, полёт на самолёте).
Так как «серповидные» эритроциты плохо проходят через капилляры тканей, они часто закупоривают сосуды и создают тем самым локальную гипоксию. Это повышает концентрацию дезоксигемоглобина S в эритроцитах, скорость образования агрегатов гемоглобина S и ещё большую деформацию эритроцитов. Нарушение доставки О2 в ткани вызывает боли и даже некроз клеток в данной области.
Серповидно-клеточная анемия – гомозиготное рецессивное заболевание; проявляется только в том случае, когда от обоих родителей наследуются 2 мутантных гена β-цепей глобина: После рождения ребёнка болезнь не проявляется до тех пор, пока значительные количества HbF не заместятся на HbS. У больных выявляют клинические симптомы, характерные для анемии: головокружение и головные боли, одышка, учащённое сердцебиение, боли в конечностях, повышенную восприимчивость к инфекционным заболеваниям.
Гетерозиготные индивидуумы, имеющие один нормальный ген HbA, а другой ген HbS, в крови имеют лишь следовые количества серповидных клеток и нормальную продолжительность жизни; клинические симптомы болезни у них обычно не проявляются.
б)Эти изменения могут быть результатом точечных мутаций
| № 5 Кислород необходим клеткам для процессов окисления веществ и получения энергии. Недостаток кислорода, также как его избыток, губителен для тканей. Каким образом регулируется количество О2, доставляемого в ткани в соответствии с клеточными потребностями? При ответе объясните:
а) Что такое эффект Бора;
б) Как связан этот эффект с метаболической активностью тканей
Окисление органических веществ с целью получения энергии происходит в митохондриях клеток с использованием О2, доставляемого гемоглобином из лёгких. В результате окисления веществ образуются конечные продукты распада – СО3 и Н2О, количество которых пропорционально интенсивности процессов окисления. СО2, образовавшийся в тканях, транспортируется в эритроциты. Там под действием фермента карбангидразы происходит увеличение скорости образования Н2СО3. Слабая угольная кислота может диссоциировать на Н+ и НСО3-
 CO2 + H2O ßà H2CO3 ßà H+ + HCO3-
Равновесие реакции в эритроцитах, находящихся в капиллярах тканей, смещается вправо, так как образующиеся в результате диссоциации угольной кислоты протоны могут присоединяться к специфическим участкам молекулы гемоглобина: к радикалам Гис146 двух β-цепей, радикалам Гис122 и концевым α-амин о группам двух α-цепей. Все эти 6 участков при переходе гемоглобина от окси- к дезоксиформе приобретают большее сродство к Н+ в результате локального изменения аминокислотного окружения вокруг этих участков (приближения к ним отрицательно заряженных карбоксильных групп аминокислот).
а)Присоединение 3 пар протонов к гемоглобину уменьшает его сродство к О2 и усиливает транспорт О2 в ткани, нуждающиеся в нём. Увеличение освобождения О2 гемоглобином в зависимости от концентрации Н+ называют эффектом Бора (по имени датского физиолога Христиана Бора, впервые открывшего этот эффект).
б)В капиллярах лёгких высокое парциальное давление О2 приводит к оксигенированию гемоглобина и удалению 6 протонов. Реакция СО2 + Н2О ßà Н2СО3 ßà Н+ + НСО3- сдвигается влево и образующийся СО2 выделяется в альвеолярное пространство и удаляется с выдыхаемым воздухом.
Следовательно, молекула гемоглобина в ходе эволюции приобрела способность воспринимать и реагировать на информацию, получаемую из окружающей среды. Увеличение концентрации протонов в среде снижает сродство О2 к гемоглобину и усиливает его транспорт в ткани.
Большая часть СО2 транспортируется кровью в виде бикарбоната НСО3–
CO2 + H2O ßà H2CO3 ßà H+ + HCO3-
Равновесие реакции в эритроцитах, находящихся в капиллярах тканей, смещается вправо, так как образующиеся в результате диссоциации угольной кислоты протоны могут присоединяться к специфическим участкам молекулы гемоглобина: к радикалам Гис146 двух β-цепей, радикалам Гис122 и концевым α-амин о группам двух α-цепей. Все эти 6 участков при переходе гемоглобина от окси- к дезоксиформе приобретают большее сродство к Н+ в результате локального изменения аминокислотного окружения вокруг этих участков (приближения к ним отрицательно заряженных карбоксильных групп аминокислот).
а)Присоединение 3 пар протонов к гемоглобину уменьшает его сродство к О2 и усиливает транспорт О2 в ткани, нуждающиеся в нём. Увеличение освобождения О2 гемоглобином в зависимости от концентрации Н+ называют эффектом Бора (по имени датского физиолога Христиана Бора, впервые открывшего этот эффект).
б)В капиллярах лёгких высокое парциальное давление О2 приводит к оксигенированию гемоглобина и удалению 6 протонов. Реакция СО2 + Н2О ßà Н2СО3 ßà Н+ + НСО3- сдвигается влево и образующийся СО2 выделяется в альвеолярное пространство и удаляется с выдыхаемым воздухом.
Следовательно, молекула гемоглобина в ходе эволюции приобрела способность воспринимать и реагировать на информацию, получаемую из окружающей среды. Увеличение концентрации протонов в среде снижает сродство О2 к гемоглобину и усиливает его транспорт в ткани.
Большая часть СО2 транспортируется кровью в виде бикарбоната НСО3–
| | |
| | № 7 В клетках костного мозга протекает следующий метаболический путь:
E1 E2 E3 E4 En
Глицин + Сукцинил-КоА → 5-аминолевулиновая кислота ↔ Р2 ↔ Р3 ↔ P4 ........... ↔ P
При повышении концентрации конечного продукта синтез его прекращается. Объясните, как регулируется скорость процесса, для этого:
а) Назовите, какие ферменты являются регуляторными в данной цепи реакций;
б) Нарисуйте схему строения одного из регуляторных ферментов, перечислите его структурно-функциональные особенности и укажите все лиганды, которые могут взаимодействовать с этим ферментом;
в) Назовите вид регуляции активности фермента данного метаболического пути.
Процесс – синтез гема.
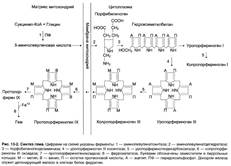 а) Регуляторные ферменты – аминолевулинатсинтаза и аминолевулинатдегидратаза.
б)
а) Регуляторные ферменты – аминолевулинатсинтаза и аминолевулинатдегидратаза.
б)
 Особенности строения и функционирования аллостерических ферментов:
· обычно это олигомерные белки, состоящие из нескольких протомеров или имеющие доменное строение;
· они имеют аллостерический центр, пространственно удалённый от каталитического активного центра;
· эффекторы присоединяются к ферменту нековалентно в аллостерических (регуляторных) центрах;
· аллостерические центры, так же, как и каталитические, могут проявлять различную специфичность по отношению к лигандам: она может быть абсолютной и групповой. Некоторые ферменты имеют несколько аллостерических центров, одни из которых специфичны к активаторам, другие – к ингибиторам.
· протомер, на котором находится аллостерический центр, – регуляторный протомер, в отличие от каталитического протомера, содержащего активный центр, в котором проходит химическая реакция; аллостерические ферменты обладают свойством кооперативности: взаимодействие аллостерического эффектора с аллостерическим центром вызывает последовательное кооперативное изменение конформации всех субъединиц, приводящее к изменению конформации активного центра и изменению сродства фермента к субстрату, что снижает или увеличивает каталитическую активность фермента.
· регуляция аллостерических ферментов обратима: отсоединение эффектора от регуляторной субъединицы восстанавливает исходную каталитическую активность фермента;
· аллостерические ферменты катализируют ключевые реакции данного метаболического пути.
Лаганд здесь – железосвязывающий белок.
в) Аллостерическое ингибирование:
Особенности строения и функционирования аллостерических ферментов:
· обычно это олигомерные белки, состоящие из нескольких протомеров или имеющие доменное строение;
· они имеют аллостерический центр, пространственно удалённый от каталитического активного центра;
· эффекторы присоединяются к ферменту нековалентно в аллостерических (регуляторных) центрах;
· аллостерические центры, так же, как и каталитические, могут проявлять различную специфичность по отношению к лигандам: она может быть абсолютной и групповой. Некоторые ферменты имеют несколько аллостерических центров, одни из которых специфичны к активаторам, другие – к ингибиторам.
· протомер, на котором находится аллостерический центр, – регуляторный протомер, в отличие от каталитического протомера, содержащего активный центр, в котором проходит химическая реакция; аллостерические ферменты обладают свойством кооперативности: взаимодействие аллостерического эффектора с аллостерическим центром вызывает последовательное кооперативное изменение конформации всех субъединиц, приводящее к изменению конформации активного центра и изменению сродства фермента к субстрату, что снижает или увеличивает каталитическую активность фермента.
· регуляция аллостерических ферментов обратима: отсоединение эффектора от регуляторной субъединицы восстанавливает исходную каталитическую активность фермента;
· аллостерические ферменты катализируют ключевые реакции данного метаболического пути.
Лаганд здесь – железосвязывающий белок.
в) Аллостерическое ингибирование:

| № 8 Ферменты глюко- и гексокиназа катализируют одинаковую реакцию. Напишите реакцию, протекающую под действием этих ферментов; укажите различие в активности, регуляции и локализации этих ферментов. Объясните биологическое значение наличия в организме двух ферментов катализирующих одинаковую реакцию.
Глюко- и гексокиназа катализируют реакцию фосфорилирования глюкозы.  В превращениях в клетках глюкоза и другие моносахариды участвуют только в виде фосфорных эфиров. Фосфорилирование свободных моносахаридов – обязательная реакция на пути их использования, она приводит к образованию более реакционно-способных соединений и поэтому может рассматриваться как реакция активации.
Глюкоза, поступающая в клетки органов и тканей, сразу же подвергается фосфорилированию с использованием АТФ. Эту реакцию во многих тканях катализирует фермент гексокиназа, а в печени и поджелудочной железе – фермент глюкокиназа. Фосфорилирование глюкозы – практически необратимая реакция, так как она протекает с использованием значительного количества энергии. Образование глюкозо-6-фосфата в клетке – своеобразная «ловушка» для глюкозы, так как мембрана клетки непроницаема для фосфорилированной глюкозы (нет соответствующих транспортных белков). Кроме того, фосфорилирование уменьшает концентрацию свободной глюкозы в цитоплазме. В результате создаются благоприятные условия для облегчённой диффузии глюкозы в клетки из крови.
Глюкокиназа.
Фосфорилирование глюкозы в гепатоцитах в период пищеварения обеспечивается свойствами глюкокиназы, которая имеет высокое значение КМ – 10 ммоль/л. В этот период концентрация глюкозы в воротной вене больше, чем в других отделах кровяного русла и может превышать 10 ммоль/л, а следовательно, активность глюкокиназы в гепатоцитах повышается. Следует отметить, что активность глюкокиназы, в отличие от гексокиназы, не ингибируется продуктом катализируемой реакции – глюкозо-6-фосфатом. Это обстоятельство обеспечивает повышение концентрации глюкозы в клетке в фосфорилиро ванной форме, соответственно её уровню в крови. Как уже упоминалось, глюкоза проникает в гепатоциты путём облегчённой диффузии при участии транспортёра ГЛЮТ-2 (независимого от инсулина). ГЛЮТ-2, так же, как глюкокиназа, имеет высокую КМ, что способствует повышению скорости поступления глюкозы в гепатоциты в период пищеварения, следовательно, ускоряет её фосфорилирование и дальнейшее использование для депонирования.
Хотя инсулин и не влияет на транспорт глюкозы, он усиливает приток глюкозы в гепатоциты в период пищеварения косвенным путём, индуцируя синтез глюкокиназы и ускоряя тем самым фосфорилирование глюкозы.
Преимущественное потребление глюкозы гепатоцитами, обусловленное свойствами глюкокиназы, предотвращает чрезмерное повышение её концентрации в крови в абсорбтивном периоде. Это, в свою очередь, снижает последствия протекания нежелательных реакций с участием глюкозы, например гликозилирования белков.
Гексокиназа.
Отличается от глюкокиназы высоким сродством к глюкозе (КМ < 0,1 ммоль/л). Следовательно, этот фермент, в отличие от глюкокиназы, активен при низкой концентрации глюкозы в крови, что характерно для постабсорбтивного состояния. Печень в этот период поглощает гораздо меньше глюкозы, так как скорость её внутриклеточного фосфорилирования глюкокиназой резко снижается. Тогда как потребление глюкозы мозгом, эритроцитами и другими тканями обеспечивается активной в этих условиях гексокиназой. Фермент гексокиназа может катализировать фосфорилирование не только D-глюкозы, но и других гексоз, хотя и с меньшей скоростью. Активность гексокиназы изменяется в зависимости от потребностей клетки в энергии. В качестве регуляторов выступают соотношение АТФ/АДФ и внутриклеточный уровень глюкозо-6-фосфата (продукта катализируемой реакции). При снижении расхода энергии в клетке повышается уровень АТФ (относительно АДФ) и глюкозо-6-фосфа-та. В этом случае активность гексокиназы снижается, и, следовательно, уменьшается скорость поступления глюкозы в клетку.
Следует отметить, что в разных тканях гексокиназа присутствует в различных изоформах, отличающихся величиной КМ. Глюкокиназа печени (и почек) является изоформой IV (гексокиназа IV). В клетках мышц содержится гексокиназа II,а в клетках опухолевых тканей преобладает гексокиназа III,с более высоким, чем у гексокиназы II,сродством к глюкозе.
В превращениях в клетках глюкоза и другие моносахариды участвуют только в виде фосфорных эфиров. Фосфорилирование свободных моносахаридов – обязательная реакция на пути их использования, она приводит к образованию более реакционно-способных соединений и поэтому может рассматриваться как реакция активации.
Глюкоза, поступающая в клетки органов и тканей, сразу же подвергается фосфорилированию с использованием АТФ. Эту реакцию во многих тканях катализирует фермент гексокиназа, а в печени и поджелудочной железе – фермент глюкокиназа. Фосфорилирование глюкозы – практически необратимая реакция, так как она протекает с использованием значительного количества энергии. Образование глюкозо-6-фосфата в клетке – своеобразная «ловушка» для глюкозы, так как мембрана клетки непроницаема для фосфорилированной глюкозы (нет соответствующих транспортных белков). Кроме того, фосфорилирование уменьшает концентрацию свободной глюкозы в цитоплазме. В результате создаются благоприятные условия для облегчённой диффузии глюкозы в клетки из крови.
Глюкокиназа.
Фосфорилирование глюкозы в гепатоцитах в период пищеварения обеспечивается свойствами глюкокиназы, которая имеет высокое значение КМ – 10 ммоль/л. В этот период концентрация глюкозы в воротной вене больше, чем в других отделах кровяного русла и может превышать 10 ммоль/л, а следовательно, активность глюкокиназы в гепатоцитах повышается. Следует отметить, что активность глюкокиназы, в отличие от гексокиназы, не ингибируется продуктом катализируемой реакции – глюкозо-6-фосфатом. Это обстоятельство обеспечивает повышение концентрации глюкозы в клетке в фосфорилиро ванной форме, соответственно её уровню в крови. Как уже упоминалось, глюкоза проникает в гепатоциты путём облегчённой диффузии при участии транспортёра ГЛЮТ-2 (независимого от инсулина). ГЛЮТ-2, так же, как глюкокиназа, имеет высокую КМ, что способствует повышению скорости поступления глюкозы в гепатоциты в период пищеварения, следовательно, ускоряет её фосфорилирование и дальнейшее использование для депонирования.
Хотя инсулин и не влияет на транспорт глюкозы, он усиливает приток глюкозы в гепатоциты в период пищеварения косвенным путём, индуцируя синтез глюкокиназы и ускоряя тем самым фосфорилирование глюкозы.
Преимущественное потребление глюкозы гепатоцитами, обусловленное свойствами глюкокиназы, предотвращает чрезмерное повышение её концентрации в крови в абсорбтивном периоде. Это, в свою очередь, снижает последствия протекания нежелательных реакций с участием глюкозы, например гликозилирования белков.
Гексокиназа.
Отличается от глюкокиназы высоким сродством к глюкозе (КМ < 0,1 ммоль/л). Следовательно, этот фермент, в отличие от глюкокиназы, активен при низкой концентрации глюкозы в крови, что характерно для постабсорбтивного состояния. Печень в этот период поглощает гораздо меньше глюкозы, так как скорость её внутриклеточного фосфорилирования глюкокиназой резко снижается. Тогда как потребление глюкозы мозгом, эритроцитами и другими тканями обеспечивается активной в этих условиях гексокиназой. Фермент гексокиназа может катализировать фосфорилирование не только D-глюкозы, но и других гексоз, хотя и с меньшей скоростью. Активность гексокиназы изменяется в зависимости от потребностей клетки в энергии. В качестве регуляторов выступают соотношение АТФ/АДФ и внутриклеточный уровень глюкозо-6-фосфата (продукта катализируемой реакции). При снижении расхода энергии в клетке повышается уровень АТФ (относительно АДФ) и глюкозо-6-фосфа-та. В этом случае активность гексокиназы снижается, и, следовательно, уменьшается скорость поступления глюкозы в клетку.
Следует отметить, что в разных тканях гексокиназа присутствует в различных изоформах, отличающихся величиной КМ. Глюкокиназа печени (и почек) является изоформой IV (гексокиназа IV). В клетках мышц содержится гексокиназа II,а в клетках опухолевых тканей преобладает гексокиназа III,с более высоким, чем у гексокиназы II,сродством к глюкозе.
| № 9 Пациента с жалобами на боль в груди в течение 3 дней госпитализировали с подозрением на инфаркт миокарда. Результаты биохимического анализа крови подтвердили диагноз. Опишите метод энзимодиагностики и объясните:
а) Какие особенности состава и распределения ферментов лежат в основе метода энзимодиагностики;
б) Активность каких ферментов определяли в крови пациента и для какого из этих ферментов она была наибольшей на третьи сутки болезни, напишите реакции, катализируемыми этими ферментами.
а) Энзимодиагностика заключается в постановке диагноза заболевания (или синдрома) на основе определения активности ферментов в биологических жидкостях человека. Принципы энзимодиагностики основаны на следующих позициях:
· при повреждении клеток в крови или других биологических жидкостях (например, в моче) увеличивается концентрация внутри клеточных ферментов повреждённых клеток;
· количество высвобождаемого фермента достаточно для его обнаружения;
· активность ферментов в биологических жидкостях, обнаруживаемых при повреждении клеток, стабильна в течение достаточно длительного времени и отличается от нормальных значений;
· ряд ферментов имеет преимущественную или абсолютную локализацию в определённых органах (органоспецифичность);
· существуют различия во внутриклеточной локализации ряда ферментов.
б) При инфаркте миокарда наблюдают достоверные изменения в крови активности ферментов КК, ЛДГ и аспартатаминотрансферазы – АСТ, которые зависят от времени, прошедшего от начала развития инфаркта и от зоны тканевого повреждения. После закупорки (окклюзии) коронарного сосуда в крови вначале отмечают повышение активности КК изоформы МВ, однако фермент быстро удаляется из кровотока. Обнаружение повышенной активности КК в плазме крови – основной энзимодиагностический критерий инфаркта миокарда. Если у пациента с загрудинными болями не обнаружено изменения в активности КК, диагноз инфаркта миокарда маловероятен.


 Дополнительным подтверждением диагноза инфаркта миокарда служит обнаружение активностей ферментов АСТ и ЛДГ в крови больных. Динамика изменений этих активностей также представлена на этом рисунке. Активность АСТ в норме составляет 5-40 МЕ/л. При инфаркте миокарда активность АСТ повышается через 4-6 ч, максимум активности наблюдают в течение 2-3 дней. Уровень ЛДГ также увеличивается в крови через несколько часов после закупорки кровеносного сосуда; максимум активности наблюдают на 3-4-й день, затем наступает постепенная нормализация активности. Уровень повышения активности ЛДГ коррелирует с размерами повреждения сердечной мышцы.
Дополнительным подтверждением диагноза инфаркта миокарда служит обнаружение активностей ферментов АСТ и ЛДГ в крови больных. Динамика изменений этих активностей также представлена на этом рисунке. Активность АСТ в норме составляет 5-40 МЕ/л. При инфаркте миокарда активность АСТ повышается через 4-6 ч, максимум активности наблюдают в течение 2-3 дней. Уровень ЛДГ также увеличивается в крови через несколько часов после закупорки кровеносного сосуда; максимум активности наблюдают на 3-4-й день, затем наступает постепенная нормализация активности. Уровень повышения активности ЛДГ коррелирует с размерами повреждения сердечной мышцы.

| | |
|
| | № 10 Ростовые факторы стимулируют клетку к вступлению в G1 фазу клеточного цикла. В ходе этой фазы индуцируется синтез ферментов, катализирующих образование дезоксирибонукдеотидов из рибонуклеотидов. Изобразите схему процесса, в котором в качестве субстратов используются дезоксирибонуклеотиды, назовите ферменты и укажите фазу клеточного цикла, в ходе которой он протекает.
Синтез дезоксирибонуклеотидов идёт с заметной скоростью только в тех клетках, которые вступают в S-фазу клеточного цикла и готовятся к синтезу ДНК и делению. В покоящихся клетках дезоксинуклеотиды практически отсутствуют. Все дезоксинуклеотиды, кроме тимидиловых, образуются из рибонуклеотидов путём прямого восстановления ОН-группы у второго углеродного атома рибозы в составе рибонуклеозиддифосфатов до дезоксирибозы. Тимидиловые нуклеотиды синтезируются из dУМФ особым путём с участием N5,N10-метилен-Н4-фолата.
Тимидин-5'-монофосфат (дТМФ) образуется из дУМФ в реакции, катализируемой тимидилатсинтазой. Донором метильной группы, появляющейся в 5-положении пиримидинового кольца в молекуле дТМФ, служит кофермент тимидилатсинтазы – N5,N10-метилен-Н4-фолат. С помощью этого кофермента в молекулу дУМФ включается метиленовая группа и восстанавливается в метальную, используя 2 атома водорода от Н4-фолата.
Образование субстрата тимидилатсинтазной реакции – дУМФ осуществляется двумя путями:
· дефосфорилироваиием дУДФ;
· гидролитическим дезаминированием дЦМФ с помощью дЦМФ дезаминазы. дЦМФ получается при дефосфорилировании дЦДФ – одного из продуктов рибонуклеотидредуктазной реакции. В организме человека это основной путь образования дУМФ.
Скорость синтеза дТМФ зависит также от количества второго субстрата тимидилатсинтазной реакции – N5,N'°-метилен-Н4-фолата, пополнение запасов которого осуществляется при участии 2 ферментов: дигидрофолатредуктазы, которая с участием NADPH восстанавливает Н2-фолат в Н4-фолат, и серин гидроксиметилтрансферазы, осуществляющей перенос β-гидроксиметиленовой группы серина на Н4-фолат. У человека дТМФ образуется, главным образом, из дЦДФ.

| № 11 Препарат доксорубицин в клетке связывается с ДНК, внедряясь между азотистыми основаниями. Кроме этого он генерирует образование активных форм кислорода, которые вызывают разрывы в молекуле ДНК. Назовите группу заболеваний, для лечения которых используется этот препарат, нарисуйте схему матричного биосинтеза, который прекращается под действием этого препарата.
Заболевания – лейкозы, рак молочной железы, лёгких, яичников.
Прекращается репликация ДНК.
Одноцепочные разрывы ДНК соединяет ДНК-липаза.
Основные этапы процесса: 1. Формирование репликационной вилки. 2. Синтез новых цепей ДНК. 3. Исключение праймеров.
Ферменты:
1. ДНК-топоизомераза – разрывает цепи 3—5 фосфодиэфирные связи.
2. ДНК хеликаза – использует энергию АТФ, для расплетения двойной спирали ДНК.
3. SSB белок - не даёт нитям скрутиться обратно в спираль, держит их.
4. ДНК полимераза γ – удлиняет уже имеющийся участок, работает на лидирующей цепи.
5. ДНК-полимераза ε - синтез отстающей цепи.
6. ДНК-лигаза – сшивает фрагменты Оказаки после удаления прамера
7. ДНК-β – удаляет праймер.

| № 12 Образование пиримидиновых димеров часто происходит в клетках кожи, например, под действием УФО. Обычно у здоровых людей эти повреждения исправляются. Однако в случае пигментной ксеродермы у больных проявляется сверхчувствительность к УФО. На коже появляются пятна, короста, и часто развивается рак кожи. Почему таким больным рекомендуется избегать пребывание на солнце? Для ответа изобразите схему защиты организма, исправляющую такого рода повреждения, укажите ферменты и их функции.
Удаление пиримидиновых димеров происходит под действием фотолиазы.
 Происходит образование циклобутанового кольца.
Фотолиаза расщепляет циклобутановое кольцо, возвращает нативную структуру нуклеотидов.
Происходит образование циклобутанового кольца.
Фотолиаза расщепляет циклобутановое кольцо, возвращает нативную структуру нуклеотидов.
| | |
| | |
| | № 13 Действие стероидного гормона кальцитриола на клетки кишечника приводит к увеличению количества белков-переносчиков, обеспечивающих всасывание пищевого Ca. Какой матричный процесс кальцитриол индуцирует первично в клетках кишечника? Отвечая на вопрос:
а) Напишите схему и суммарное уравнение этого процесса;
б) Укажите, каким модификациям подвергается вновь синтезированная нуклеиновая кислота, для того, чтобы служить матрицей для синтеза других молекул.
а) Гормон связавшись с рецептором в клетке, поступает в ядро, и там взаимодействует с регуляторной нуклеотидной последовательностью в ДНК, и индуцирует транскрипцию структурных генов, в результате чего синтезируются белки переносчики.
 Суммарное уравнение: aATP+bGTP+cCTP+dUTP+ДНК=РНК+ДНК+(a+b+c+d)PPi (?)
б) Модификация 5’конца - кэпирование (начинается на стадии элонгации), это обеспечивает инициацию трансляции; модификация 3’конца - формирование полиАпоследовательности. далее происходит сплайсинг.
Суммарное уравнение: aATP+bGTP+cCTP+dUTP+ДНК=РНК+ДНК+(a+b+c+d)PPi (?)
б) Модификация 5’конца - кэпирование (начинается на стадии элонгации), это обеспечивает инициацию трансляции; модификация 3’конца - формирование полиАпоследовательности. далее происходит сплайсинг.
| № 14 В процессе формирования атеросклеротической бляшки происходит повреждение эндотелия. В ответ на повреждение активируются тромбоциты, которые секретируют тромбоксаны TXA2. TXA2 стимулируют пролиферацию гладкомышечных клеток (ГМК) и их миграцию в область повреждения. Как тромбоксаны повышают количество ГМК? Для ответа на вопрос:
а) Укажите, какие матричные процессы активируются в ГМК после стимуляции тромбоксанами;
б) Нарисуйте схему и опишите один из этих процессов, течение которого в значительной мере зависит от поступления Мет в клетки и возможности его регенерации их гомоцистеина.
а)Активируется траснкрипция, трансляция. Происходит сокращение ГМК. Эйкозанойды действуют на клетки через специальные рецепторы. Некоторые рецепторы эйкозанойдов связаны с аденилатциклазной системой и протеинкиназой А. Эти рецепторы действуют через механизмы, увеличивающие уровень кальция в цитозоле клеток - мишеней. В норме клетки эндотелия сосудов продуцируют простациклин I2, который препятствует агрегации тромбоцитов и сужению сосудов.
б)


| № 15 Известно, что при повышении концентрации гема фактор инициации eIF2 активируется. В результате этого количество гемоглобина в организме увеличивается, Какой процесс с участием eIF2 ускоряется и изменяет уровень Нb этих условиях? Для ответа изобразите схему процесса, перечислите ферменты, субстраты, источники энергии.
Процесс – трансляция, стадия транслокации, идет при элонгации.


| | |
| | |
| | № 16 Для поддержания температуры тела при колебаниях температуры окружающей среды организм изменяет скорость окисления «топливных» молекул, Так, при дрожании мышц на холоде увеличивается использование АТФ как источника энергии для их сокращения, и больше «топливных» молекул окисляется. Почему в этом случае человек согревается? Для ответа изобразите схему, иллюстрирующую механизм синтеза АТФ при участии изоцитрата как энергоносителя.
При сокращении мышц только 20 % тратится непосредственно на сокращение, 80 % приходится на тепло, поэтому человек согревается.

| № 17 При недостатке поступления О2 в ткани развивается гипоэнергетическое состояние, которое может привести к воспалительной реакции, а затем и некрозу данной области. Почему гипоксия вызывает снижение синтеза АТФ и почему уменьшение синтеза АТФ приводит к гибели клетки? Напишите соответствующие схемы.
Гипоксия вызывает снижение синтеза АТФ, так как O2 – конечный акцептор электронов в ЦПЭ.
Уменьшение синтеза АТФ может привести к гибели клетки, так как у клетки не будет необходимого количества энергии.

| № 18 При преобладании в пище очищенных круп или хлеба, приготовленного из муки высшего сорта может возникнуть гиповитаминоз В1. Объясните, какую роль играет витамин В1 в организме. Для этого:
а) Назовите кофермент в состав которого входит витамин В1 и ферменты, для функционирования которых требуется этот кофермент;
б) Напишите процесс, в котором участвуют эти ферменты, и объясните, как изменится скорость процесса при недостатке В1.
а) Кофермент: ТДФ – дифосфорный эфир тиомина.
Ферменты: пируват- и α-кетоглутаратдегидрогензные комплексы, транскетолаза.
б)Пируват- и α-кетоглутаратдегидрогензные комплексы – окислительное декарбоксилирование пирувата и α-кетоглутарата. Транскетолаза – Пентозофосфатный путь превращения углеводов.
При недостатке витамина скорость этих процессов уменьшается.
Окислительное декарбоксилирование пирувата.
 Превращение Пирувата в Ацетил-КоА включает 5 стадий.
Стадия 1. На этой стадии пируват соединяется с ТДФ в составе E1 и подвергается окислительному декарбоксилированию.
Пируват + E1-ТДФ → Гидроксиэтил-ТДФ + CO2. В результате этой реакции образуется производное ТДФ с гидроксиэтильной группой при тиазоловом кольце.
Стадия 2. Дигидролипоилтрансацетилаза (E2) катализирует перенос атома водорода и ацетильной группы от ТДФ на окисленную форму липоиллизиновых групп с образованием ацетилтиоэфира липоевой кислоты. Стадия 3. На стадии 3 КоА взаимодействует с ацетильным производным E2, в результате чего образуются ацетил-КоА и полностью восстановленный липоильный остаток, простетическая группа Е2.
Стадия 4. На стадии 4 дигидролипоилдегидрогеназа (Е3) катализирует перенос атомов водорода от восстановленных липоильных групп на FAD – простетическую группу фермента Е3.
Стадия 5. На стадии 5 восстановленный FADH, передаёт водород на NAD+ с образованием NADH.
Пентозофосфатный путь:
Превращение Пирувата в Ацетил-КоА включает 5 стадий.
Стадия 1. На этой стадии пируват соединяется с ТДФ в составе E1 и подвергается окислительному декарбоксилированию.
Пируват + E1-ТДФ → Гидроксиэтил-ТДФ + CO2. В результате этой реакции образуется производное ТДФ с гидроксиэтильной группой при тиазоловом кольце.
Стадия 2. Дигидролипоилтрансацетилаза (E2) катализирует перенос атома водорода и ацетильной группы от ТДФ на окисленную форму липоиллизиновых групп с образованием ацетилтиоэфира липоевой кислоты. Стадия 3. На стадии 3 КоА взаимодействует с ацетильным производным E2, в результате чего образуются ацетил-КоА и полностью восстановленный липоильный остаток, простетическая группа Е2.
Стадия 4. На стадии 4 дигидролипоилдегидрогеназа (Е3) катализирует перенос атомов водорода от восстановленных липоильных групп на FAD – простетическую группу фермента Е3.
Стадия 5. На стадии 5 восстановленный FADH, передаёт водород на NAD+ с образованием NADH.
Пентозофосфатный путь:

| | |
| | № 19 Авитаминоз В1 приводит к нарушению синтеза АТФ клетками нервной системы и развитию полиневритов. Какую роль играет этот витамин в метаболизме? Почему его недостаток приводит к поражению нервной ткани? При ответе используйте схемы метаболических путей и реакции.
Биологическая рольвитамина В,определяется тем, что в виде ТДФ он входит в состав как минимум трёх ферментов и ферментных комплексов: в составе пируват- и а-кетоглутаратдегидрогеназных комплексов он участвует в окислительном декарбокси-лировании пирувата и а-кетоглутарата; в составе транскетолазы ТДФ участвует впентозофосфатном пути превращения углеводов.
Основной, наиболее характерный и специфический признак недостаточности витамина В, — полиневрит, в основе которого лежат дегенеративные изменения нервов. Вначале развивается болезненность вдоль нервных стволов, затем — потеря кожной чувствительности и наступает паралич (бери-бери).
Окислительное декарбоксилирование пирувата.
 Превращение Пирувата в Ацетил-КоА включает 5 стадий.
Стадия 1. На этой стадии пируват соединяется с ТДФ в составе E1 и подвергается окислительному декарбоксилированию.
Пируват + E1-ТДФ → Гидроксиэтил-ТДФ + CO2. В результате этой реакции образуется производное ТДФ с гидроксиэтильной группой при тиазоловом кольце.
Стадия 2. Дигидролипоилтрансацетилаза (E2) катализирует перенос атома водорода и ацетильной группы от ТДФ на окисленную форму липоиллизиновых групп с образованием ацетилтиоэфира липоевой кислоты. Стадия 3. На стадии 3 КоА взаимодействует с ацетильным производным E2, в результате чего образуются ацетил-КоА и полностью восстановленный липоильный остаток, простетическая группа Е2.
Стадия 4. На стадии 4 дигидролипоилдегидрогеназа (Е3) катализирует перенос атомов водорода от восстановленных липоильных групп на FAD – простетическую группу фермента Е3.
Стадия 5. На стадии 5 восстановленный FADH, передаёт водород на NAD+ с образованием NADH.
Пентозофосфатный путь:
Превращение Пирувата в Ацетил-КоА включает 5 стадий.
Стадия 1. На этой стадии пируват соединяется с ТДФ в составе E1 и подвергается окислительному декарбоксилированию.
Пируват + E1-ТДФ → Гидроксиэтил-ТДФ + CO2. В результате этой реакции образуется производное ТДФ с гидроксиэтильной группой при тиазоловом кольце.
Стадия 2. Дигидролипоилтрансацетилаза (E2) катализирует перенос атома водорода и ацетильной группы от ТДФ на окисленную форму липоиллизиновых групп с образованием ацетилтиоэфира липоевой кислоты. Стадия 3. На стадии 3 КоА взаимодействует с ацетильным производным E2, в результате чего образуются ацетил-КоА и полностью восстановленный липоильный остаток, простетическая группа Е2.
Стадия 4. На стадии 4 дигидролипоилдегидрогеназа (Е3) катализирует перенос атомов водорода от восстановленных липоильных групп на FAD – простетическую группу фермента Е3.
Стадия 5. На стадии 5 восстановленный FADH, передаёт водород на NAD+ с образованием NADH.
Пентозофосфатный путь:

| № 20 Цитратный цикл выполняет не только катаболические функции. Его метаболиты активно используются для синтеза других веществ. Приведите примеры анаболических функций ЦТК, написав соответствующие реакции и схемы. Каким образом восполняется утечка метаболитов? Напишите реакцию, назовите фермент и кофермент. К каким последствиям может привести дефект этого фермента?
Анаболические функции ЦТК.
Цикл лимонной кислоты — один из амфиболических путей метаболизма. В нём осуществляются не только окислительные превращения энергетических субстратов до конечных продуктов СО2 и Н2О, но и происходит образование субстратов для других метаболических путей.
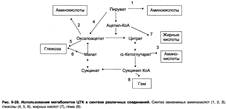 Некоторые промежуточные продукты цикла лимонной кислоты: α-кетоглутарат, сукцинат, оксалоацетат могут использоваться для синтеза заменимых аминокислот.
Восполнение утечки метаболитов.
Убыль промежуточных продуктов цикла восполняется в реакциях, катализируемых специфическими ферментами. В нормальных условиях реакции, отвлекающие промежуточные продукты из цикла и восполняющие их убыль, находятся в состоянии динамического равновесия, так что концентрация этих продуктов в митохондриях остаётся постоянной.
Реакции, обеспечивающие пополнение фонда промежуточных продуктов ЦТК, называются анаплеротическими (пополняющими). Важнейшая из них — реакция синтеза оксалоацетата из пирувата. Эту реакцию катализирует митохондриальный фермент — пируваткарбоксилаза.
Некоторые промежуточные продукты цикла лимонной кислоты: α-кетоглутарат, сукцинат, оксалоацетат могут использоваться для синтеза заменимых аминокислот.
Восполнение утечки метаболитов.
Убыль промежуточных продуктов цикла восполняется в реакциях, катализируемых специфическими ферментами. В нормальных условиях реакции, отвлекающие промежуточные продукты из цикла и восполняющие их убыль, находятся в состоянии динамического равновесия, так что концентрация этих продуктов в митохондриях остаётся постоянной.
Реакции, обеспечивающие пополнение фонда промежуточных продуктов ЦТК, называются анаплеротическими (пополняющими). Важнейшая из них — реакция синтеза оксалоацетата из пирувата. Эту реакцию катализирует митохондриальный фермент — пируваткарбоксилаза.
 Пируваткарбоксилаза — регуляторный фермент. Если концентрация ацетил-КоА увеличивается, то он действует как аллостерический активатор пируваткарбоксилазы, ускоряя образование оксалоацетата. Таким образом, избыток ацетил-КоА способствует активации цитратного цикла.
Последствия.
Пируваткарбоксилаза катализирует превращение пирувата в оксалоацетат для глюконеогенеза. А если не будет аксалоацетата, то не будет глюконеогенеза. А из-за этого в результате может быть гипогликемия натощак.
Пируваткарбоксилаза — регуляторный фермент. Если концентрация ацетил-КоА увеличивается, то он действует как аллостерический активатор пируваткарбоксилазы, ускоряя образование оксалоацетата. Таким образом, избыток ацетил-КоА способствует активации цитратного цикла.
Последствия.
Пируваткарбоксилаза катализирует превращение пирувата в оксалоацетат для глюконеогенеза. А если не будет аксалоацетата, то не будет глюконеогенеза. А из-за этого в результате может быть гипогликемия натощак.
| | № 21 Если к суспензии митохондрий, использующих в качестве единственного субстрата дыхания пировиноградную кислоту, добавить малоновую кислоту, то поглощение О2 митохондриями резко снижается и накапливается один из промежуточных продуктов метаболизма. Какой метаболит накапливается и почему снижается поглощение О2? Для ответа на вопрос:
а) Назовите вещество, которое накапливается, напишите схему процесса, в котором это соединение является промежуточным продуктом;
б) Объясните, почему прекращается поглощение О2;
в) Укажите, каким способом можно снять вызванное малонатом ингибирование.
а) Оксалоацетат
  б)
б)
 Снижается, потому что доноры водорода образуются только в одной реакции ЦТК: окисления малата в оксалоацетат. Все остальные донорные реакции не идут, потому что в среде нет пирувата.
в) Нужно связать оксалоацетат, добавив пируват или ацетил-КоА
Снижается, потому что доноры водорода образуются только в одной реакции ЦТК: окисления малата в оксалоацетат. Все остальные донорные реакции не идут, потому что в среде нет пирувата.
в) Нужно связать оксалоацетат, добавив пируват или ацетил-КоА
| | |
| | |
| | № 22 Весной у многих людей развивается гиповитаминоз, обусловленный снижением в пище количества витамина В5 (пантотеновой кислоты). Наиболее характерными признаками этого гиповитаминоза является сонливость и повышенная утомляемость. Почему дефицит витамина В5 может привести к таким состояниям? Для ответа:
а) Укажите, предшественником какого кофермента является витамин В5, в каких процессах он участвует;
б) Приведите схему метаболического пути, протекающего в мышцах при выполнении физической нагрузки и укажите реакцию, в которой участвует этот кофермент;
в) Перечислите другие возможные причины гипоэнергетических состояний.
а) Кофермент HSKoA.
Пантотеновая кислота используется в клетках для синтеза коферментов: 4-фосфапантотеина и КоА. 4-фосфапантотеин – кофермент пальмитоилсинтазы. КоА участвует в переносе ацильных радикалов в реакциях общего пути катаболизма, активации жирных кислот, синтеза холестерина и кетоновых тел, синтеза ацетилглюкозаминов, обезвреживания чужеродных веществ в печени.
Пантотеновая кислота является ферментом в пируватдегидрогеназном комплексе и α-кетоглутаратдегидрогеназном комплексе.
б)
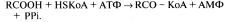
 Реакция, которая написана перед окислением и та, в которой ферментом является β-кетоацил-КоА-тиолаза.
в) Голодание, гиповитаминозы B1, PP, B2; гипоксия.
Реакция, которая написана перед окислением и та, в которой ферментом является β-кетоацил-КоА-тиолаза.
в) Голодание, гиповитаминозы B1, PP, B2; гипоксия.
| № 23 У тренированных людей в скелетных мышцах увеличивается количество митохондрий и миоглобина. Как у этих людей изменится продукция лактата мышцами по сравнению с нетренированными при одинаковой физической нагрузке? При ответе:
а) Напишите схему метаболического пути, конечным продуктом которого является лактат;
б) Объясните, как и почему активность этого метаболического пути будет отличаться у тренированных людей и не тренированных.
а)
 б) У нетренированных людей лактоацидоз возникает при физической работе как следствие относительного недостатка кислорода в мышцах и развивается достаточно быстро. Компенсация осуществляется путём гипервентиляции. У тренированных людей много кислорода запасено в миоглобине. Гипоксия мышцы развивается позже или при бОльших нагрузках. Большое количество митохондрий обеспечивает быстрое и высокоэффективное аэробное окисление требуемого количества энергоносителей.
б) У нетренированных людей лактоацидоз возникает при физической работе как следствие относительного недостатка кислорода в мышцах и развивается достаточно быстро. Компенсация осуществляется путём гипервентиляции. У тренированных людей много кислорода запасено в миоглобине. Гипоксия мышцы развивается позже или при бОльших нагрузках. Большое количество митохондрий обеспечивает быстрое и высокоэффективное аэробное окисление требуемого количества энергоносителей.
| № 24 Гликоген - разветвленный органический полимер. Как связаны особенности строения гликогена с его функцией в организме? Где и для каких целей синтезируется гликоген и в каких ситуациях используется? Ответ обоснуйте, представив соответствующие биохимические схемы.
1. Гликоген – разветвлённый гомополимер глюкозы, в котором остатки глюкозы соединены в линейных участках α-1,4-гликозидной связью. В точках ветвления мономеры соединены α-1,6-гликозидными связями.
При полимеризации глюкозы снижается растворимость образующейся молекулы гликогена и, следовательно, её влияние на осмотическое давление в клетке. Это объясняет , почему в клетке депонируется гликоген, а не свободная глюкоза.
Разветвлённая структура гликогена обуславливает большое количество концевых мономеров, что способствует работе ферментов, отщепляющих или присоединяющих мономеры при распаде или синтезе гликогена, так как эти ферменты могут одновременно работать на нескольких ветвях молекулы.
2. Гликоген синтезируется в период пищеварения (через 1-2 часа после приёма углеводной пищи). Гликоген депонируется в печени и мышцах. Распад его происходит в ответ на повышение потребности организма в глюкозе.
 
| | № 25 У больных с печеночной формой гликогеноза, болезнью Гирке, в крови повышена концентрация лактата и мочевой кислоты. Почему при этом заболевании наблюдается лактоацидоз? Для ответа:
а) Напишите схему метаболического пути, активность которого снижена у больного, на схеме укажите место ферментного «блока», укажите фермент;
б) Укажите, в какие метаболические пути включается «конечный» продукт этого процесса;
в) Объясните происхождение лактата, концентрация которого повышена в крови больного.
а) Распад гликогена
 Глюкоза-6-фосфат не переходит в глюкозу из-за дефекта фермента глюкозо-6-фосфатазы
б), в)Из-за увеличения содержания в клетках глюкозо-6-фосфата возрастает его использование в пентофосфатном пути с образованием рибозо-5-фосфата, который является субстратом для синтеза пуриновых нуклеотидов. Их образуется и разрушается больше, в связи с этим увеличивается концентрация мочевой кислоты, как продукта распада нуклеотидов.
Увеличение содержания в клетках глюкозо-6-фосфата приводит к его избыточному превращению в пируват и лактат. Накопление лактата приводит к лактоацидозу. Ацидоз в свою очередь приводит к снижению pH мочи, что также затрудняет выведение мочевой кислоты и уратов.
Глюкоза-6-фосфат не переходит в глюкозу из-за дефекта фермента глюкозо-6-фосфатазы
б), в)Из-за увеличения содержания в клетках глюкозо-6-фосфата возрастает его использование в пентофосфатном пути с образованием рибозо-5-фосфата, который является субстратом для синтеза пуриновых нуклеотидов. Их образуется и разрушается больше, в связи с этим увеличивается концентрация мочевой кислоты, как продукта распада нуклеотидов.
Увеличение содержания в клетках глюкозо-6-фосфата приводит к его избыточному превращению в пируват и лактат. Накопление лактата приводит к лактоацидозу. Ацидоз в свою очередь приводит к снижению pH мочи, что также затрудняет выведение мочевой кислоты и уратов.
| № 26 При недостаточности тиамина (В1) наблюдается снижение работоспособности, быстрая утомляемость. Больные жалуются на судороги в мышцах, что может быть объяснено повышенным содержанием органической кислоты в клетках мышц. Какая органическая кислота накапливается в тканях в этих условиях? При ответе:
а) Укажите роль тиамина в метаболизме, приведите примеры реакций, в которых он участвует;
б) Объясните, какая органическая кислота накапливается в мышцах в этих условиях и напишите схему метаболического пути, активация которого приводит к ее накоплению.
а) Тиамин входит в состав ферментных комплексов. Он участвует в окислительном декарбоксилировании пирувата и α-кетоглутарата, а в составе ТДФ участвкет в пентозофосфатном пути превращения углеводов.
Пируват + NAD+ + HSKoA → Ацетил-КоА + NADH+H+ + CO2
б) Кислота – лактат.
Анаэробный распад глюкозы
 А если недостаточность тиамина:
А если недостаточность тиамина:

| № 27 Человек получил с пищей 200г углеводов и затем не принимал пищу в течение суток. Опишите состояние обмена гликогена у данного человека через 1 час после еды и через 14 часов, написав соответствующие схемы. Объясните отличие в мобилизации гликогена в печени и мышцах.
Через 1 час – синтез гликогена. Через 14 часов – распад гликогена.
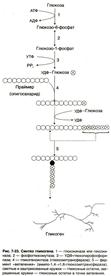  В печени присутствует фермент Глюкозо-6-фосфатаза, а в мышцах его нет, поэтому глюкоза из гликогена в мышцах может использоваться только там, а в печени также может идти в кровь и поддерживать уровень себя в крови.
В печени присутствует фермент Глюкозо-6-фосфатаза, а в мышцах его нет, поэтому глюкоза из гликогена в мышцах может использоваться только там, а в печени также может идти в кровь и поддерживать уровень себя в крови.
| | |
| | № 28 После предшествующего 5-часового перерыва в приеме пищи, студентка выпила сладкий чай с пирожным. Как изменится обмен углеводов в печени в этой ситуации? При ответе представьте схемы, объясняющие как гормоны «переключают» обмен углеводов в печени при переходе от постабсорбтивного состояния к абсорбтивному.
Углеводы пойдут на синтез жиров и произойдёт их депонирование, также произойдёт активация аэробного гликолиза и синтез гликогена.
Синтез жирных кислотСинтез гликогена (ниже)
  Аэробный распад глюкозы
Аэробный распад глюкозы

| № 29 Спортсмен совершает 5-километровую пробежку. Укажите, поток каких метаболитов увеличивается из мышц в печень к концу дистанции. Напишите краткие схемы возможных превращений этих веществ в печени в данной ситуации. Объясните значение этих процессов.
 У спортсмена совершающего пробежку в интенсивно работающих мышцах происходят процессы гликолиза, при этом в результате анаэробного гликолиза (в первые минуты - при нехватке кислорода (затем идет аэробный), и при длительной работе) образуется лактат. Он вступает в "глюкозо-лактатный цикл", или цикл "Кори".
У спортсмена совершающего пробежку в интенсивно работающих мышцах происходят процессы гликолиза, при этом в результате анаэробного гликолиза (в первые минуты - при нехватке кислорода (затем идет аэробный), и при длительной работе) образуется лактат. Он вступает в "глюкозо-лактатный цикл", или цикл "Кори".
 В печени отношение NADH\NAD+ ниже, чем в сокращающейся мышце, поэтому лактатдегидрогеназная реакция протекает в сторону образования пирувата из лактата. Далее пируват включается в глюкогенез, а образовавшаяся глюкоза поступает в кровь и поглощается скелетными мышцами.
Значение.
1) утилизация лактата - предотвращение лактоацидоза;
2) синтез глюкозы
При длительной мышечной работе могут образовываться аминокислоты, в результате распада мышечных белков, которые при катаболизме превращаются в пируват или метаболиты цитратного цикла (гликогенный аминокислоты) и способны включаться в глюконеогенез.
В печени отношение NADH\NAD+ ниже, чем в сокращающейся мышце, поэтому лактатдегидрогеназная реакция протекает в сторону образования пирувата из лактата. Далее пируват включается в глюкогенез, а образовавшаяся глюкоза поступает в кровь и поглощается скелетными мышцами.
Значение.
1) утилизация лактата - предотвращение лактоацидоза;
2) синтез глюкозы
При длительной мышечной работе могут образовываться аминокислоты, в результате распада мышечных белков, которые при катаболизме превращаются в пируват или метаболиты цитратного цикла (гликогенный аминокислоты) и способны включаться в глюконеогенез.
 Значение: транспорт аминного азота из мышц в печень и предотвращение лактоацидоза.
Значение: транспорт аминного азота из мышц в печень и предотвращение лактоацидоза.
| № 30 При длительной физической работе в крови повышается концентрация лактата. Объясните, как лактат может использоваться в этой ситуации в миокарде, напишите схему соответствующего метаболического пути.
 Пируват потом переходит в ЦТК.
Пируват потом переходит в ЦТК.

| | № 33 Основное значение регуляции скоростей синтеза и распада гликогена в печени заключается в поддержании постоянной концентрации глюкозы в крови. Укажите концентрацию глюкозы в крови в норме. Объясните роль гормонов в регуляции активности ключевых ферментов обмена гликогена. Ответ проиллюстрируйте соответствующими схемами.
Концентрация глюкозы в норме: 3,3-5,5 ммоль/л (60-100 мг/дл).
Гормоны, регулирующие метаболизм гликогена: инсулин и глюкагон. Первичный сигнал для их синтеза - изменение концентрации глюкозы в крови. При повышении инсулин/глюкагонового индекса идет синтез гликогена, при понижении - распад.
Механизм действия глюкагона:
 Влияние инсулина:
Влияние инсулина:
 Так же на обмен гликогена может влиять адреналин в экстремальной ситуации.
Так же на обмен гликогена может влиять адреналин в экстремальной ситуации.
 Какая система передачи сигнала в клетку будет использована, зависит от рецепторов, с которыми взаимодействует адреналин.
Какая система передачи сигнала в клетку будет использована, зависит от рецепторов, с которыми взаимодействует адреналин.
| | № 32 Из клеток печени двух крыс был выделен бифункциональный фермент (БИФ), в фосфорилированной и дефосфорилированной формах, имеющих разную ферментативную активность. Объясните особенности функционирования этого фермента. Какую роль играет БИФ в регуляции обмена углеводов в печени животных?
 Бифункциональный фермент (БИФ) катализирует прямую и обратную реакции образования фруктозо-2,6-бисфосфата путём фосфорилирования фруктозо-6-фосфата. Однако превращение фруктозо-2,6-бисфосфата в фрук-тозо-6-фосфат не является обратимым процессом. Образование фруктозо-2,6-бисфосфата требует затрат АТФ, а при образовании фруктозо-6-фосфата из фруктозо-2,6-бисфосфата гидролитически отщепляется неорганический фосфат.
В реакции фосфорилирования фруктозо-6-фосфата фермент проявляет киназную активность, а при дефосфорилировании образованного фруктозо-2,6-бисфосфата — фосфатазную. Это обстоятельство и определило название фермента «бифункциональный».
Киназная активность БИФ проявляется, когда фермент находится в дефосфорилированной форме (БИФ-ОН). Дефосфорилированная форма БИФ характерна для абсорбтивного периода, когда инсулин/глюкагоновый индекс высокий. В этот период количество фруктозо-2,6-бисфос-фата увеличивается.
При низком инсулин-глюкагоновом индексе, характерном для периода длительного голодания, происходит фосфорилирование БИФ, и он функционирует как фосфатаза. Результат — снижение количества фруктозо-2,6-бисфосфата.
Киназную и фосфатазную реакции катализируют разные активные центры БИФ, но в каждом из двух состояний фермента (фосфорили-рованном и дефосфорилированном) один из активных центров ингибирован. Регуляторное влияние фруктозо-2,6-бисфосфата заключается в том, что он аллостерически активирует фосфофруктокиназу (фермент гликолиза). При этом фруктозо-2,6-бисфосфат снижает ингибирующее действие АТФ на этот фермент в абсорбтивном периоде и повышает его сродство к фруктозо-6-фосфату. В то же время фруктозо-2,6-бисфос-фат ингибирует фруктозо-1,6-бисфосфатазу (фермент глюконеогенеза). Итак, в абсорбтивном периоде уровень фруктозо-2,6-бисфосфата повышается, что приводит к активации фосфофруктокиназы и ускорению гликолиза. Результатом уменьшения количества фруктозо-2,6-бисфосфата в постабсорбтивном периоде будет снижение активности фосфофруктокиназы, замедление гликолиза и переключение гликолиза на глюконеогенез. Бифункциональный фермент (БИФ) катализирует прямую и обратную реакции образования фруктозо-2,6-бисфосфата путём фосфорилирования фруктозо-6-фосфата. Однако превращение фруктозо-2,6-бисфосфата в фрук-тозо-6-фосфат не является обратимым процессом. Образование фруктозо-2,6-бисфосфата требует затрат АТФ, а при образовании фруктозо-6-фосфата из фруктозо-2,6-бисфосфата гидролитически отщепляется неорганический фосфат.
В реакции фосфорилирования фруктозо-6-фосфата фермент проявляет киназную активность, а при дефосфорилировании образованного фруктозо-2,6-бисфосфата — фосфатазную. Это обстоятельство и определило название фермента «бифункциональный».
Киназная активность БИФ проявляется, когда фермент находится в дефосфорилированной форме (БИФ-ОН). Дефосфорилированная форма БИФ характерна для абсорбтивного периода, когда инсулин/глюкагоновый индекс высокий. В этот период количество фруктозо-2,6-бисфос-фата увеличивается.
При низком инсулин-глюкагоновом индексе, характерном для периода длительного голодания, происходит фосфорилирование БИФ, и он функционирует как фосфатаза. Результат — снижение количества фруктозо-2,6-бисфосфата.
Киназную и фосфатазную реакции катализируют разные активные центры БИФ, но в каждом из двух состояний фермента (фосфорили-рованном и дефосфорилированном) один из активных центров ингибирован. Регуляторное влияние фруктозо-2,6-бисфосфата заключается в том, что он аллостерически активирует фосфофруктокиназу (фермент гликолиза). При этом фруктозо-2,6-бисфосфат снижает ингибирующее действие АТФ на этот фермент в абсорбтивном периоде и повышает его сродство к фруктозо-6-фосфату. В то же время фруктозо-2,6-бисфос-фат ингибирует фруктозо-1,6-бисфосфатазу (фермент глюконеогенеза). Итак, в абсорбтивном периоде уровень фруктозо-2,6-бисфосфата повышается, что приводит к активации фосфофруктокиназы и ускорению гликолиза. Результатом уменьшения количества фруктозо-2,6-бисфосфата в постабсорбтивном периоде будет снижение активности фосфофруктокиназы, замедление гликолиза и переключение гликолиза на глюконеогенез.
| | № 31 При смене абсорбтивного состояния на постабсорбтивное в печени происходит переключение гликолиза на глюконеогенез. Каким образом изменение секреции гормонов и метаболитов регулирует этот процесс? Ответ аргументируйте соответствующими схемами.
Количество инсулина падает, а глюкагона возрастает. В печени скорость синтеза жирных кислот уменьшается, а скорость β-окисления и синтеза кетоновых тел увеличивается. В жировой ткани скорость синтеза ТАГ уменьшается.
Происходит изменение активности и количества ферментов гликолиза и глюконеогенеза.

| | |
| | | № 34 На дистанции два бегуна: спринтер завершает стометровку, стайер бежит десятый километр. Укажите различия в энергетическом обеспечении работы мышц у этих бегунов. Приведите схемы метаболических путей в обмене углеводов и липидов, которые являются источником энергии у стайера и спринтера.
|
|

 • кислоты и щелочи, изменяют рН среды.
• соли тяжёлых металлов (такие как медь, ртуть, серебро, свинец и др.)
• детергенты – вещества, содержащие гидрофобный углеводородный радикал и гидрофильную функциональную группу (такие вещества называют амфифильными).
Удаление денатурирующих агентов диализом приводит к восстановлению конформации и функции белка, т.е. к ренативации.
Молекулярные шапероны предотвращаютденатурацию белков.
В клетках имеются белки – молекулярные шапероны,которые обладают способностью связываться с частично денатурированными, находящимися в неустойчивом, склонном к агрегации состоянии белками и восстанавливать их нативную конформацию.
Вначале эти белки были обнаружены как белкитеплового шока,так как их синтез усиливался при стрессовых воздействиях на клетку, например при повышении температуры (индуцибельные шапероны), но существуют также и конститутивные шапероны, высокий базальный синтез которых не зависит от стрессовых условий.
Шапероны (Ш) классифицируются по массе субъединиц. Разлияают 6 классов:
· Высокомолекулярные (100-110 кД)
· Ш-90 (83-90 кД)
· Ш-70 (60-78 кД)
· Ш-60
· Ш-40
· Низкомолекулярные (15-30 кД)
• кислоты и щелочи, изменяют рН среды.
• соли тяжёлых металлов (такие как медь, ртуть, серебро, свинец и др.)
• детергенты – вещества, содержащие гидрофобный углеводородный радикал и гидрофильную функциональную группу (такие вещества называют амфифильными).
Удаление денатурирующих агентов диализом приводит к восстановлению конформации и функции белка, т.е. к ренативации.
Молекулярные шапероны предотвращаютденатурацию белков.
В клетках имеются белки – молекулярные шапероны,которые обладают способностью связываться с частично денатурированными, находящимися в неустойчивом, склонном к агрегации состоянии белками и восстанавливать их нативную конформацию.
Вначале эти белки были обнаружены как белкитеплового шока,так как их синтез усиливался при стрессовых воздействиях на клетку, например при повышении температуры (индуцибельные шапероны), но существуют также и конститутивные шапероны, высокий базальный синтез которых не зависит от стрессовых условий.
Шапероны (Ш) классифицируются по массе субъединиц. Разлияают 6 классов:
· Высокомолекулярные (100-110 кД)
· Ш-90 (83-90 кД)
· Ш-70 (60-78 кД)
· Ш-60
· Ш-40
· Низкомолекулярные (15-30 кД)
 Ш-70 способны защищать белки от температурной инактивации и восстанавливать конформацию и активность частично денатурированных белков.
Различные семейства шаперонов, обнаруженные практически во всех отделах клетки, участвуют в таких фундаментальных процессах, как:
1) ренативация частично денатурированных белков;
2) узнавание денатурированных белков и транспорт их в лизосомы;
3) синтез белков;
4) формирование трехмерной структуры белков;
5) сборка олигомерных белков;
6) транспорт белков через мембраны;
7) функционирование белковых комплексов и контроль за изменением между активной и неактивной конформацией.
Ш-70 способны защищать белки от температурной инактивации и восстанавливать конформацию и активность частично денатурированных белков.
Различные семейства шаперонов, обнаруженные практически во всех отделах клетки, участвуют в таких фундаментальных процессах, как:
1) ренативация частично денатурированных белков;
2) узнавание денатурированных белков и транспорт их в лизосомы;
3) синтез белков;
4) формирование трехмерной структуры белков;
5) сборка олигомерных белков;
6) транспорт белков через мембраны;
7) функционирование белковых комплексов и контроль за изменением между активной и неактивной конформацией.
 В дезоксигемоглобине S имеется участок, комплементарный другому участку таких же молекул, содержащему изменённую аминокислоту. В результате молекулы дезоксигемоглобина начинают «слипаться», образуя удлинённые фибриллярные агрегаты, деформирующие эритроцит и приводящие к образованию аномальных эритроцитов в виде серпа.
В оксигемоглобине S комплементарный участок «замаскирован» в результате изменения конформации белка. Недоступность участка препятствует соединению молекул оксигемоглобина 8 друг с другом. Следовательно, образованию агрегатов HbS способствуют условия, повышающие концентрацию дезоксигемоглобина в клетках (физическая работа, гипоксия, уменьшение pH, условия высокогорья, полёт на самолёте).
Так как «серповидные» эритроциты плохо проходят через капилляры тканей, они часто закупоривают сосуды и создают тем самым локальную гипоксию. Это повышает концентрацию дезоксигемоглобина S в эритроцитах, скорость образования агрегатов гемоглобина S и ещё большую деформацию эритроцитов. Нарушение доставки О2 в ткани вызывает боли и даже некроз клеток в данной области.
Серповидно-клеточная анемия – гомозиготное рецессивное заболевание; проявляется только в том случае, когда от обоих родителей наследуются 2 мутантных гена β-цепей глобина: После рождения ребёнка болезнь не проявляется до тех пор, пока значительные количества HbF не заместятся на HbS. У больных выявляют клинические симптомы, характерные для анемии: головокружение и головные боли, одышка, учащённое сердцебиение, боли в конечностях, повышенную восприимчивость к инфекционным заболеваниям.
Гетерозиготные индивидуумы, имеющие один нормальный ген HbA, а другой ген HbS, в крови имеют лишь следовые количества серповидных клеток и нормальную продолжительность жизни; клинические симптомы болезни у них обычно не проявляются.
HbC, мутация происходит в β-цепи в 6 положении, Глу меняется на Лиз.
В дезоксигемоглобине S имеется участок, комплементарный другому участку таких же молекул, содержащему изменённую аминокислоту. В результате молекулы дезоксигемоглобина начинают «слипаться», образуя удлинённые фибриллярные агрегаты, деформирующие эритроцит и приводящие к образованию аномальных эритроцитов в виде серпа.
В оксигемоглобине S комплементарный участок «замаскирован» в результате изменения конформации белка. Недоступность участка препятствует соединению молекул оксигемоглобина 8 друг с другом. Следовательно, образованию агрегатов HbS способствуют условия, повышающие концентрацию дезоксигемоглобина в клетках (физическая работа, гипоксия, уменьшение pH, условия высокогорья, полёт на самолёте).
Так как «серповидные» эритроциты плохо проходят через капилляры тканей, они часто закупоривают сосуды и создают тем самым локальную гипоксию. Это повышает концентрацию дезоксигемоглобина S в эритроцитах, скорость образования агрегатов гемоглобина S и ещё большую деформацию эритроцитов. Нарушение доставки О2 в ткани вызывает боли и даже некроз клеток в данной области.
Серповидно-клеточная анемия – гомозиготное рецессивное заболевание; проявляется только в том случае, когда от обоих родителей наследуются 2 мутантных гена β-цепей глобина: После рождения ребёнка болезнь не проявляется до тех пор, пока значительные количества HbF не заместятся на HbS. У больных выявляют клинические симптомы, характерные для анемии: головокружение и головные боли, одышка, учащённое сердцебиение, боли в конечностях, повышенную восприимчивость к инфекционным заболеваниям.
Гетерозиготные индивидуумы, имеющие один нормальный ген HbA, а другой ген HbS, в крови имеют лишь следовые количества серповидных клеток и нормальную продолжительность жизни; клинические симптомы болезни у них обычно не проявляются.
HbC, мутация происходит в β-цепи в 6 положении, Глу меняется на Лиз.
 В дезоксигемоглобине S имеется участок, комплементарный другому участку таких же молекул, содержащему изменённую аминокислоту. В результате молекулы дезоксигемоглобина начинают «слипаться», образуя удлинённые фибриллярные агрегаты, деформирующие эритроцит и приводящие к образованию аномальных эритроцитов в виде серпа.
В оксигемоглобине S комплементарный участок «замаскирован» в результате изменения конформации белка. Недоступность участка препятствует соединению молекул оксигемоглобина 8 друг с другом. Следовательно, образованию агрегатов HbS способствуют условия, повышающие концентрацию дезоксигемоглобина в клетках (физическая работа, гипоксия, уменьшение pH, условия высокогорья, полёт на самолёте).
Так как «серповидные» эритроциты плохо проходят через капилляры тканей, они часто закупоривают сосуды и создают тем самым локальную гипоксию. Это повышает концентрацию дезоксигемоглобина S в эритроцитах, скорость образования агрегатов гемоглобина S и ещё большую деформацию эритроцитов. Нарушение доставки О2 в ткани вызывает боли и даже некроз клеток в данной области.
Полиморфизм белков.
Амплификация генов, независимые мутации в копиях и рекомбинации приводят к дивергенции (расхождению) свойств соответствующих белков. Результатом этих процессов является усложнение генома в филогенезе и образование семейств родственных белков с близкой аминокислотной последовательностью и функциями или полиморфные разновидности одного и того же белка.
Другой важный пример полиморфизма белков, связанный с проблемой переливания крови, – существование в популяции людей 3 аллельных вариантов гена фермента гликозилтрансферазы (А, В и 0).
В дезоксигемоглобине S имеется участок, комплементарный другому участку таких же молекул, содержащему изменённую аминокислоту. В результате молекулы дезоксигемоглобина начинают «слипаться», образуя удлинённые фибриллярные агрегаты, деформирующие эритроцит и приводящие к образованию аномальных эритроцитов в виде серпа.
В оксигемоглобине S комплементарный участок «замаскирован» в результате изменения конформации белка. Недоступность участка препятствует соединению молекул оксигемоглобина 8 друг с другом. Следовательно, образованию агрегатов HbS способствуют условия, повышающие концентрацию дезоксигемоглобина в клетках (физическая работа, гипоксия, уменьшение pH, условия высокогорья, полёт на самолёте).
Так как «серповидные» эритроциты плохо проходят через капилляры тканей, они часто закупоривают сосуды и создают тем самым локальную гипоксию. Это повышает концентрацию дезоксигемоглобина S в эритроцитах, скорость образования агрегатов гемоглобина S и ещё большую деформацию эритроцитов. Нарушение доставки О2 в ткани вызывает боли и даже некроз клеток в данной области.
Полиморфизм белков.
Амплификация генов, независимые мутации в копиях и рекомбинации приводят к дивергенции (расхождению) свойств соответствующих белков. Результатом этих процессов является усложнение генома в филогенезе и образование семейств родственных белков с близкой аминокислотной последовательностью и функциями или полиморфные разновидности одного и того же белка.
Другой важный пример полиморфизма белков, связанный с проблемой переливания крови, – существование в популяции людей 3 аллельных вариантов гена фермента гликозилтрансферазы (А, В и 0).
 В дезоксигемоглобине S имеется участок, комплементарный другому участку таких же молекул, содержащему изменённую аминокислоту. В результате молекулы дезоксигемоглобина начинают «слипаться», образуя удлинённые фибриллярные агрегаты, деформирующие эритроцит и приводящие к образованию аномальных эритроцитов в виде серпа.
В оксигемоглобине S комплементарный участок «замаскирован» в результате изменения конформации белка. Недоступность участка препятствует соединению молекул оксигемоглобина 8 друг с другом. Следовательно, образованию агрегатов HbS способствуют условия, повышающие концентрацию дезоксигемоглобина в клетках (физическая работа, гипоксия, уменьшение pH, условия высокогорья, полёт на самолёте).
Так как «серповидные» эритроциты плохо проходят через капилляры тканей, они часто закупоривают сосуды и создают тем самым локальную гипоксию. Это повышает концентрацию дезоксигемоглобина S в эритроцитах, скорость образования агрегатов гемоглобина S и ещё большую деформацию эритроцитов. Нарушение доставки О2 в ткани вызывает боли и даже некроз клеток в данной области.
ДНК à Первичная структура белка à Вторичная структура белка à Третичная структура белка à Образование уникальной формы активного центра à Избирательное связывание лигандов à Специфическая функция белка
Другие заболевания:
α-Талассемиивозникают при нарушении синтеза α-цепей. В геноме каждого индивидуума существует 4 копии гена α-глобина (по 2 копии на каждой хромосоме), поэтому встречаются несколько видов недостаточности α -цепей. Если дефектна одна из 4 копий, то фенотипически это не проявляется, и такого человека рассматривают как «молчащего носителя» талассемии. При дефекте в 2 копиях гена у носителя мутации обнаруживают слабовыраженные признаки болезни, а при дефекте в 3 копиях развивается гемолитическая анемия. При полном отсутствии синтеза α -цепей (т.е. дефектны все 4 копии гена) наступает внутриутробная гибель плода, так как не образуются фетальные формы Hb, а тетрамеры γ 4 обладают высоким сродством к кислороду и не способны функционировать как транспортные белки.
β-Талассемииразвиваются в результате снижения синтеза β-цепей Hb, для которых на каждой хромосоме имеется по одному гену. Синтез HbA начинается после рождения ребёнка. При дефекте в одной из копий гена недостаточность Hb проявляется в слабой степени и не требует специального лечения. Однако при полном включении синтеза β-цепей развивается тяжёлая форма анемии, и таким пациентам провод либо периодическую трансфузию крови, либо пересадку костного мозга.
В дезоксигемоглобине S имеется участок, комплементарный другому участку таких же молекул, содержащему изменённую аминокислоту. В результате молекулы дезоксигемоглобина начинают «слипаться», образуя удлинённые фибриллярные агрегаты, деформирующие эритроцит и приводящие к образованию аномальных эритроцитов в виде серпа.
В оксигемоглобине S комплементарный участок «замаскирован» в результате изменения конформации белка. Недоступность участка препятствует соединению молекул оксигемоглобина 8 друг с другом. Следовательно, образованию агрегатов HbS способствуют условия, повышающие концентрацию дезоксигемоглобина в клетках (физическая работа, гипоксия, уменьшение pH, условия высокогорья, полёт на самолёте).
Так как «серповидные» эритроциты плохо проходят через капилляры тканей, они часто закупоривают сосуды и создают тем самым локальную гипоксию. Это повышает концентрацию дезоксигемоглобина S в эритроцитах, скорость образования агрегатов гемоглобина S и ещё большую деформацию эритроцитов. Нарушение доставки О2 в ткани вызывает боли и даже некроз клеток в данной области.
ДНК à Первичная структура белка à Вторичная структура белка à Третичная структура белка à Образование уникальной формы активного центра à Избирательное связывание лигандов à Специфическая функция белка
Другие заболевания:
α-Талассемиивозникают при нарушении синтеза α-цепей. В геноме каждого индивидуума существует 4 копии гена α-глобина (по 2 копии на каждой хромосоме), поэтому встречаются несколько видов недостаточности α -цепей. Если дефектна одна из 4 копий, то фенотипически это не проявляется, и такого человека рассматривают как «молчащего носителя» талассемии. При дефекте в 2 копиях гена у носителя мутации обнаруживают слабовыраженные признаки болезни, а при дефекте в 3 копиях развивается гемолитическая анемия. При полном отсутствии синтеза α -цепей (т.е. дефектны все 4 копии гена) наступает внутриутробная гибель плода, так как не образуются фетальные формы Hb, а тетрамеры γ 4 обладают высоким сродством к кислороду и не способны функционировать как транспортные белки.
β-Талассемииразвиваются в результате снижения синтеза β-цепей Hb, для которых на каждой хромосоме имеется по одному гену. Синтез HbA начинается после рождения ребёнка. При дефекте в одной из копий гена недостаточность Hb проявляется в слабой степени и не требует специального лечения. Однако при полном включении синтеза β-цепей развивается тяжёлая форма анемии, и таким пациентам провод либо периодическую трансфузию крови, либо пересадку костного мозга.
 В дезоксигемоглобине S имеется участок, комплементарный другому участку таких же молекул, содержащему изменённую аминокислоту. В результате молекулы дезоксигемоглобина начинают «слипаться», образуя удлинённые фибриллярные агрегаты, деформирующие эритроцит и приводящие к образованию аномальных эритроцитов в виде серпа.
В оксигемоглобине S комплементарный участок «замаскирован» в результате изменения конформации белка. Недоступность участка препятствует соединению молекул оксигемоглобина 8 друг с другом. Следовательно, образованию агрегатов HbS способствуют условия, повышающие концентрацию дезоксигемоглобина в клетках (физическая работа, гипоксия, уменьшение pH, условия высокогорья, полёт на самолёте).
Так как «серповидные» эритроциты плохо проходят через капилляры тканей, они часто закупоривают сосуды и создают тем самым локальную гипоксию. Это повышает концентрацию дезоксигемоглобина S в эритроцитах, скорость образования агрегатов гемоглобина S и ещё большую деформацию эритроцитов. Нарушение доставки О2 в ткани вызывает боли и даже некроз клеток в данной области.
Серповидно-клеточная анемия – гомозиготное рецессивное заболевание; проявляется только в том случае, когда от обоих родителей наследуются 2 мутантных гена β-цепей глобина: После рождения ребёнка болезнь не проявляется до тех пор, пока значительные количества HbF не заместятся на HbS. У больных выявляют клинические симптомы, характерные для анемии: головокружение и головные боли, одышка, учащённое сердцебиение, боли в конечностях, повышенную восприимчивость к инфекционным заболеваниям.
Гетерозиготные индивидуумы, имеющие один нормальный ген HbA, а другой ген HbS, в крови имеют лишь следовые количества серповидных клеток и нормальную продолжительность жизни; клинические симптомы болезни у них обычно не проявляются.
б)Эти изменения могут быть результатом точечных мутаций
В дезоксигемоглобине S имеется участок, комплементарный другому участку таких же молекул, содержащему изменённую аминокислоту. В результате молекулы дезоксигемоглобина начинают «слипаться», образуя удлинённые фибриллярные агрегаты, деформирующие эритроцит и приводящие к образованию аномальных эритроцитов в виде серпа.
В оксигемоглобине S комплементарный участок «замаскирован» в результате изменения конформации белка. Недоступность участка препятствует соединению молекул оксигемоглобина 8 друг с другом. Следовательно, образованию агрегатов HbS способствуют условия, повышающие концентрацию дезоксигемоглобина в клетках (физическая работа, гипоксия, уменьшение pH, условия высокогорья, полёт на самолёте).
Так как «серповидные» эритроциты плохо проходят через капилляры тканей, они часто закупоривают сосуды и создают тем самым локальную гипоксию. Это повышает концентрацию дезоксигемоглобина S в эритроцитах, скорость образования агрегатов гемоглобина S и ещё большую деформацию эритроцитов. Нарушение доставки О2 в ткани вызывает боли и даже некроз клеток в данной области.
Серповидно-клеточная анемия – гомозиготное рецессивное заболевание; проявляется только в том случае, когда от обоих родителей наследуются 2 мутантных гена β-цепей глобина: После рождения ребёнка болезнь не проявляется до тех пор, пока значительные количества HbF не заместятся на HbS. У больных выявляют клинические симптомы, характерные для анемии: головокружение и головные боли, одышка, учащённое сердцебиение, боли в конечностях, повышенную восприимчивость к инфекционным заболеваниям.
Гетерозиготные индивидуумы, имеющие один нормальный ген HbA, а другой ген HbS, в крови имеют лишь следовые количества серповидных клеток и нормальную продолжительность жизни; клинические симптомы болезни у них обычно не проявляются.
б)Эти изменения могут быть результатом точечных мутаций
 CO2 + H2O ßà H2CO3 ßà H+ + HCO3-
Равновесие реакции в эритроцитах, находящихся в капиллярах тканей, смещается вправо, так как образующиеся в результате диссоциации угольной кислоты протоны могут присоединяться к специфическим участкам молекулы гемоглобина: к радикалам Гис146 двух β-цепей, радикалам Гис122 и концевым α-амин о группам двух α-цепей. Все эти 6 участков при переходе гемоглобина от окси- к дезоксиформе приобретают большее сродство к Н+ в результате локального изменения аминокислотного окружения вокруг этих участков (приближения к ним отрицательно заряженных карбоксильных групп аминокислот).
а)Присоединение 3 пар протонов к гемоглобину уменьшает его сродство к О2 и усиливает транспорт О2 в ткани, нуждающиеся в нём. Увеличение освобождения О2 гемоглобином в зависимости от концентрации Н+ называют эффектом Бора (по имени датского физиолога Христиана Бора, впервые открывшего этот эффект).
б)В капиллярах лёгких высокое парциальное давление О2 приводит к оксигенированию гемоглобина и удалению 6 протонов. Реакция СО2 + Н2О ßà Н2СО3 ßà Н+ + НСО3- сдвигается влево и образующийся СО2 выделяется в альвеолярное пространство и удаляется с выдыхаемым воздухом.
Следовательно, молекула гемоглобина в ходе эволюции приобрела способность воспринимать и реагировать на информацию, получаемую из окружающей среды. Увеличение концентрации протонов в среде снижает сродство О2 к гемоглобину и усиливает его транспорт в ткани.
Большая часть СО2 транспортируется кровью в виде бикарбоната НСО3–
CO2 + H2O ßà H2CO3 ßà H+ + HCO3-
Равновесие реакции в эритроцитах, находящихся в капиллярах тканей, смещается вправо, так как образующиеся в результате диссоциации угольной кислоты протоны могут присоединяться к специфическим участкам молекулы гемоглобина: к радикалам Гис146 двух β-цепей, радикалам Гис122 и концевым α-амин о группам двух α-цепей. Все эти 6 участков при переходе гемоглобина от окси- к дезоксиформе приобретают большее сродство к Н+ в результате локального изменения аминокислотного окружения вокруг этих участков (приближения к ним отрицательно заряженных карбоксильных групп аминокислот).
а)Присоединение 3 пар протонов к гемоглобину уменьшает его сродство к О2 и усиливает транспорт О2 в ткани, нуждающиеся в нём. Увеличение освобождения О2 гемоглобином в зависимости от концентрации Н+ называют эффектом Бора (по имени датского физиолога Христиана Бора, впервые открывшего этот эффект).
б)В капиллярах лёгких высокое парциальное давление О2 приводит к оксигенированию гемоглобина и удалению 6 протонов. Реакция СО2 + Н2О ßà Н2СО3 ßà Н+ + НСО3- сдвигается влево и образующийся СО2 выделяется в альвеолярное пространство и удаляется с выдыхаемым воздухом.
Следовательно, молекула гемоглобина в ходе эволюции приобрела способность воспринимать и реагировать на информацию, получаемую из окружающей среды. Увеличение концентрации протонов в среде снижает сродство О2 к гемоглобину и усиливает его транспорт в ткани.
Большая часть СО2 транспортируется кровью в виде бикарбоната НСО3–
 а) Регуляторные ферменты – аминолевулинатсинтаза и аминолевулинатдегидратаза.
б)
а) Регуляторные ферменты – аминолевулинатсинтаза и аминолевулинатдегидратаза.
б)
 Особенности строения и функционирования аллостерических ферментов:
· обычно это олигомерные белки, состоящие из нескольких протомеров или имеющие доменное строение;
· они имеют аллостерический центр, пространственно удалённый от каталитического активного центра;
· эффекторы присоединяются к ферменту нековалентно в аллостерических (регуляторных) центрах;
· аллостерические центры, так же, как и каталитические, могут проявлять различную специфичность по отношению к лигандам: она может быть абсолютной и групповой. Некоторые ферменты имеют несколько аллостерических центров, одни из которых специфичны к активаторам, другие – к ингибиторам.
· протомер, на котором находится аллостерический центр, – регуляторный протомер, в отличие от каталитического протомера, содержащего активный центр, в котором проходит химическая реакция; аллостерические ферменты обладают свойством кооперативности: взаимодействие аллостерического эффектора с аллостерическим центром вызывает последовательное кооперативное изменение конформации всех субъединиц, приводящее к изменению конформации активного центра и изменению сродства фермента к субстрату, что снижает или увеличивает каталитическую активность фермента.
· регуляция аллостерических ферментов обратима: отсоединение эффектора от регуляторной субъединицы восстанавливает исходную каталитическую активность фермента;
· аллостерические ферменты катализируют ключевые реакции данного метаболического пути.
Лаганд здесь – железосвязывающий белок.
в) Аллостерическое ингибирование:
Особенности строения и функционирования аллостерических ферментов:
· обычно это олигомерные белки, состоящие из нескольких протомеров или имеющие доменное строение;
· они имеют аллостерический центр, пространственно удалённый от каталитического активного центра;
· эффекторы присоединяются к ферменту нековалентно в аллостерических (регуляторных) центрах;
· аллостерические центры, так же, как и каталитические, могут проявлять различную специфичность по отношению к лигандам: она может быть абсолютной и групповой. Некоторые ферменты имеют несколько аллостерических центров, одни из которых специфичны к активаторам, другие – к ингибиторам.
· протомер, на котором находится аллостерический центр, – регуляторный протомер, в отличие от каталитического протомера, содержащего активный центр, в котором проходит химическая реакция; аллостерические ферменты обладают свойством кооперативности: взаимодействие аллостерического эффектора с аллостерическим центром вызывает последовательное кооперативное изменение конформации всех субъединиц, приводящее к изменению конформации активного центра и изменению сродства фермента к субстрату, что снижает или увеличивает каталитическую активность фермента.
· регуляция аллостерических ферментов обратима: отсоединение эффектора от регуляторной субъединицы восстанавливает исходную каталитическую активность фермента;
· аллостерические ферменты катализируют ключевые реакции данного метаболического пути.
Лаганд здесь – железосвязывающий белок.
в) Аллостерическое ингибирование:

 В превращениях в клетках глюкоза и другие моносахариды участвуют только в виде фосфорных эфиров. Фосфорилирование свободных моносахаридов – обязательная реакция на пути их использования, она приводит к образованию более реакционно-способных соединений и поэтому может рассматриваться как реакция активации.
Глюкоза, поступающая в клетки органов и тканей, сразу же подвергается фосфорилированию с использованием АТФ. Эту реакцию во многих тканях катализирует фермент гексокиназа, а в печени и поджелудочной железе – фермент глюкокиназа. Фосфорилирование глюкозы – практически необратимая реакция, так как она протекает с использованием значительного количества энергии. Образование глюкозо-6-фосфата в клетке – своеобразная «ловушка» для глюкозы, так как мембрана клетки непроницаема для фосфорилированной глюкозы (нет соответствующих транспортных белков). Кроме того, фосфорилирование уменьшает концентрацию свободной глюкозы в цитоплазме. В результате создаются благоприятные условия для облегчённой диффузии глюкозы в клетки из крови.
Глюкокиназа.
Фосфорилирование глюкозы в гепатоцитах в период пищеварения обеспечивается свойствами глюкокиназы, которая имеет высокое значение КМ – 10 ммоль/л. В этот период концентрация глюкозы в воротной вене больше, чем в других отделах кровяного русла и может превышать 10 ммоль/л, а следовательно, активность глюкокиназы в гепатоцитах повышается. Следует отметить, что активность глюкокиназы, в отличие от гексокиназы, не ингибируется продуктом катализируемой реакции – глюкозо-6-фосфатом. Это обстоятельство обеспечивает повышение концентрации глюкозы в клетке в фосфорилиро ванной форме, соответственно её уровню в крови. Как уже упоминалось, глюкоза проникает в гепатоциты путём облегчённой диффузии при участии транспортёра ГЛЮТ-2 (независимого от инсулина). ГЛЮТ-2, так же, как глюкокиназа, имеет высокую КМ, что способствует повышению скорости поступления глюкозы в гепатоциты в период пищеварения, следовательно, ускоряет её фосфорилирование и дальнейшее использование для депонирования.
Хотя инсулин и не влияет на транспорт глюкозы, он усиливает приток глюкозы в гепатоциты в период пищеварения косвенным путём, индуцируя синтез глюкокиназы и ускоряя тем самым фосфорилирование глюкозы.
Преимущественное потребление глюкозы гепатоцитами, обусловленное свойствами глюкокиназы, предотвращает чрезмерное повышение её концентрации в крови в абсорбтивном периоде. Это, в свою очередь, снижает последствия протекания нежелательных реакций с участием глюкозы, например гликозилирования белков.
Гексокиназа.
Отличается от глюкокиназы высоким сродством к глюкозе (КМ < 0,1 ммоль/л). Следовательно, этот фермент, в отличие от глюкокиназы, активен при низкой концентрации глюкозы в крови, что характерно для постабсорбтивного состояния. Печень в этот период поглощает гораздо меньше глюкозы, так как скорость её внутриклеточного фосфорилирования глюкокиназой резко снижается. Тогда как потребление глюкозы мозгом, эритроцитами и другими тканями обеспечивается активной в этих условиях гексокиназой. Фермент гексокиназа может катализировать фосфорилирование не только D-глюкозы, но и других гексоз, хотя и с меньшей скоростью. Активность гексокиназы изменяется в зависимости от потребностей клетки в энергии. В качестве регуляторов выступают соотношение АТФ/АДФ и внутриклеточный уровень глюкозо-6-фосфата (продукта катализируемой реакции). При снижении расхода энергии в клетке повышается уровень АТФ (относительно АДФ) и глюкозо-6-фосфа-та. В этом случае активность гексокиназы снижается, и, следовательно, уменьшается скорость поступления глюкозы в клетку.
Следует отметить, что в разных тканях гексокиназа присутствует в различных изоформах, отличающихся величиной КМ. Глюкокиназа печени (и почек) является изоформой IV (гексокиназа IV). В клетках мышц содержится гексокиназа II,а в клетках опухолевых тканей преобладает гексокиназа III,с более высоким, чем у гексокиназы II,сродством к глюкозе.
В превращениях в клетках глюкоза и другие моносахариды участвуют только в виде фосфорных эфиров. Фосфорилирование свободных моносахаридов – обязательная реакция на пути их использования, она приводит к образованию более реакционно-способных соединений и поэтому может рассматриваться как реакция активации.
Глюкоза, поступающая в клетки органов и тканей, сразу же подвергается фосфорилированию с использованием АТФ. Эту реакцию во многих тканях катализирует фермент гексокиназа, а в печени и поджелудочной железе – фермент глюкокиназа. Фосфорилирование глюкозы – практически необратимая реакция, так как она протекает с использованием значительного количества энергии. Образование глюкозо-6-фосфата в клетке – своеобразная «ловушка» для глюкозы, так как мембрана клетки непроницаема для фосфорилированной глюкозы (нет соответствующих транспортных белков). Кроме того, фосфорилирование уменьшает концентрацию свободной глюкозы в цитоплазме. В результате создаются благоприятные условия для облегчённой диффузии глюкозы в клетки из крови.
Глюкокиназа.
Фосфорилирование глюкозы в гепатоцитах в период пищеварения обеспечивается свойствами глюкокиназы, которая имеет высокое значение КМ – 10 ммоль/л. В этот период концентрация глюкозы в воротной вене больше, чем в других отделах кровяного русла и может превышать 10 ммоль/л, а следовательно, активность глюкокиназы в гепатоцитах повышается. Следует отметить, что активность глюкокиназы, в отличие от гексокиназы, не ингибируется продуктом катализируемой реакции – глюкозо-6-фосфатом. Это обстоятельство обеспечивает повышение концентрации глюкозы в клетке в фосфорилиро ванной форме, соответственно её уровню в крови. Как уже упоминалось, глюкоза проникает в гепатоциты путём облегчённой диффузии при участии транспортёра ГЛЮТ-2 (независимого от инсулина). ГЛЮТ-2, так же, как глюкокиназа, имеет высокую КМ, что способствует повышению скорости поступления глюкозы в гепатоциты в период пищеварения, следовательно, ускоряет её фосфорилирование и дальнейшее использование для депонирования.
Хотя инсулин и не влияет на транспорт глюкозы, он усиливает приток глюкозы в гепатоциты в период пищеварения косвенным путём, индуцируя синтез глюкокиназы и ускоряя тем самым фосфорилирование глюкозы.
Преимущественное потребление глюкозы гепатоцитами, обусловленное свойствами глюкокиназы, предотвращает чрезмерное повышение её концентрации в крови в абсорбтивном периоде. Это, в свою очередь, снижает последствия протекания нежелательных реакций с участием глюкозы, например гликозилирования белков.
Гексокиназа.
Отличается от глюкокиназы высоким сродством к глюкозе (КМ < 0,1 ммоль/л). Следовательно, этот фермент, в отличие от глюкокиназы, активен при низкой концентрации глюкозы в крови, что характерно для постабсорбтивного состояния. Печень в этот период поглощает гораздо меньше глюкозы, так как скорость её внутриклеточного фосфорилирования глюкокиназой резко снижается. Тогда как потребление глюкозы мозгом, эритроцитами и другими тканями обеспечивается активной в этих условиях гексокиназой. Фермент гексокиназа может катализировать фосфорилирование не только D-глюкозы, но и других гексоз, хотя и с меньшей скоростью. Активность гексокиназы изменяется в зависимости от потребностей клетки в энергии. В качестве регуляторов выступают соотношение АТФ/АДФ и внутриклеточный уровень глюкозо-6-фосфата (продукта катализируемой реакции). При снижении расхода энергии в клетке повышается уровень АТФ (относительно АДФ) и глюкозо-6-фосфа-та. В этом случае активность гексокиназы снижается, и, следовательно, уменьшается скорость поступления глюкозы в клетку.
Следует отметить, что в разных тканях гексокиназа присутствует в различных изоформах, отличающихся величиной КМ. Глюкокиназа печени (и почек) является изоформой IV (гексокиназа IV). В клетках мышц содержится гексокиназа II,а в клетках опухолевых тканей преобладает гексокиназа III,с более высоким, чем у гексокиназы II,сродством к глюкозе.


 Дополнительным подтверждением диагноза инфаркта миокарда служит обнаружение активностей ферментов АСТ и ЛДГ в крови больных. Динамика изменений этих активностей также представлена на этом рисунке. Активность АСТ в норме составляет 5-40 МЕ/л. При инфаркте миокарда активность АСТ повышается через 4-6 ч, максимум активности наблюдают в течение 2-3 дней. Уровень ЛДГ также увеличивается в крови через несколько часов после закупорки кровеносного сосуда; максимум активности наблюдают на 3-4-й день, затем наступает постепенная нормализация активности. Уровень повышения активности ЛДГ коррелирует с размерами повреждения сердечной мышцы.
Дополнительным подтверждением диагноза инфаркта миокарда служит обнаружение активностей ферментов АСТ и ЛДГ в крови больных. Динамика изменений этих активностей также представлена на этом рисунке. Активность АСТ в норме составляет 5-40 МЕ/л. При инфаркте миокарда активность АСТ повышается через 4-6 ч, максимум активности наблюдают в течение 2-3 дней. Уровень ЛДГ также увеличивается в крови через несколько часов после закупорки кровеносного сосуда; максимум активности наблюдают на 3-4-й день, затем наступает постепенная нормализация активности. Уровень повышения активности ЛДГ коррелирует с размерами повреждения сердечной мышцы.



 Происходит образование циклобутанового кольца.
Фотолиаза расщепляет циклобутановое кольцо, возвращает нативную структуру нуклеотидов.
Происходит образование циклобутанового кольца.
Фотолиаза расщепляет циклобутановое кольцо, возвращает нативную структуру нуклеотидов.
 Суммарное уравнение: aATP+bGTP+cCTP+dUTP+ДНК=РНК+ДНК+(a+b+c+d)PPi (?)
б) Модификация 5’конца - кэпирование (начинается на стадии элонгации), это обеспечивает инициацию трансляции; модификация 3’конца - формирование полиАпоследовательности. далее происходит сплайсинг.
Суммарное уравнение: aATP+bGTP+cCTP+dUTP+ДНК=РНК+ДНК+(a+b+c+d)PPi (?)
б) Модификация 5’конца - кэпирование (начинается на стадии элонгации), это обеспечивает инициацию трансляции; модификация 3’конца - формирование полиАпоследовательности. далее происходит сплайсинг.






 Превращение Пирувата в Ацетил-КоА включает 5 стадий.
Стадия 1. На этой стадии пируват соединяется с ТДФ в составе E1 и подвергается окислительному декарбоксилированию.
Пируват + E1-ТДФ → Гидроксиэтил-ТДФ + CO2. В результате этой реакции образуется производное ТДФ с гидроксиэтильной группой при тиазоловом кольце.
Стадия 2. Дигидролипоилтрансацетилаза (E2) катализирует перенос атома водорода и ацетильной группы от ТДФ на окисленную форму липоиллизиновых групп с образованием ацетилтиоэфира липоевой кислоты. Стадия 3. На стадии 3 КоА взаимодействует с ацетильным производным E2, в результате чего образуются ацетил-КоА и полностью восстановленный липоильный остаток, простетическая группа Е2.
Стадия 4. На стадии 4 дигидролипоилдегидрогеназа (Е3) катализирует перенос атомов водорода от восстановленных липоильных групп на FAD – простетическую группу фермента Е3.
Стадия 5. На стадии 5 восстановленный FADH, передаёт водород на NAD+ с образованием NADH.
Пентозофосфатный путь:
Превращение Пирувата в Ацетил-КоА включает 5 стадий.
Стадия 1. На этой стадии пируват соединяется с ТДФ в составе E1 и подвергается окислительному декарбоксилированию.
Пируват + E1-ТДФ → Гидроксиэтил-ТДФ + CO2. В результате этой реакции образуется производное ТДФ с гидроксиэтильной группой при тиазоловом кольце.
Стадия 2. Дигидролипоилтрансацетилаза (E2) катализирует перенос атома водорода и ацетильной группы от ТДФ на окисленную форму липоиллизиновых групп с образованием ацетилтиоэфира липоевой кислоты. Стадия 3. На стадии 3 КоА взаимодействует с ацетильным производным E2, в результате чего образуются ацетил-КоА и полностью восстановленный липоильный остаток, простетическая группа Е2.
Стадия 4. На стадии 4 дигидролипоилдегидрогеназа (Е3) катализирует перенос атомов водорода от восстановленных липоильных групп на FAD – простетическую группу фермента Е3.
Стадия 5. На стадии 5 восстановленный FADH, передаёт водород на NAD+ с образованием NADH.
Пентозофосфатный путь:

 Превращение Пирувата в Ацетил-КоА включает 5 стадий.
Стадия 1. На этой стадии пируват соединяется с ТДФ в составе E1 и подвергается окислительному декарбоксилированию.
Пируват + E1-ТДФ → Гидроксиэтил-ТДФ + CO2. В результате этой реакции образуется производное ТДФ с гидроксиэтильной группой при тиазоловом кольце.
Стадия 2. Дигидролипоилтрансацетилаза (E2) катализирует перенос атома водорода и ацетильной группы от ТДФ на окисленную форму липоиллизиновых групп с образованием ацетилтиоэфира липоевой кислоты. Стадия 3. На стадии 3 КоА взаимодействует с ацетильным производным E2, в результате чего образуются ацетил-КоА и полностью восстановленный липоильный остаток, простетическая группа Е2.
Стадия 4. На стадии 4 дигидролипоилдегидрогеназа (Е3) катализирует перенос атомов водорода от восстановленных липоильных групп на FAD – простетическую группу фермента Е3.
Стадия 5. На стадии 5 восстановленный FADH, передаёт водород на NAD+ с образованием NADH.
Пентозофосфатный путь:
Превращение Пирувата в Ацетил-КоА включает 5 стадий.
Стадия 1. На этой стадии пируват соединяется с ТДФ в составе E1 и подвергается окислительному декарбоксилированию.
Пируват + E1-ТДФ → Гидроксиэтил-ТДФ + CO2. В результате этой реакции образуется производное ТДФ с гидроксиэтильной группой при тиазоловом кольце.
Стадия 2. Дигидролипоилтрансацетилаза (E2) катализирует перенос атома водорода и ацетильной группы от ТДФ на окисленную форму липоиллизиновых групп с образованием ацетилтиоэфира липоевой кислоты. Стадия 3. На стадии 3 КоА взаимодействует с ацетильным производным E2, в результате чего образуются ацетил-КоА и полностью восстановленный липоильный остаток, простетическая группа Е2.
Стадия 4. На стадии 4 дигидролипоилдегидрогеназа (Е3) катализирует перенос атомов водорода от восстановленных липоильных групп на FAD – простетическую группу фермента Е3.
Стадия 5. На стадии 5 восстановленный FADH, передаёт водород на NAD+ с образованием NADH.
Пентозофосфатный путь:

 Некоторые промежуточные продукты цикла лимонной кислоты: α-кетоглутарат, сукцинат, оксалоацетат могут использоваться для синтеза заменимых аминокислот.
Восполнение утечки метаболитов.
Убыль промежуточных продуктов цикла восполняется в реакциях, катализируемых специфическими ферментами. В нормальных условиях реакции, отвлекающие промежуточные продукты из цикла и восполняющие их убыль, находятся в состоянии динамического равновесия, так что концентрация этих продуктов в митохондриях остаётся постоянной.
Реакции, обеспечивающие пополнение фонда промежуточных продуктов ЦТК, называются анаплеротическими (пополняющими). Важнейшая из них — реакция синтеза оксалоацетата из пирувата. Эту реакцию катализирует митохондриальный фермент — пируваткарбоксилаза.
Некоторые промежуточные продукты цикла лимонной кислоты: α-кетоглутарат, сукцинат, оксалоацетат могут использоваться для синтеза заменимых аминокислот.
Восполнение утечки метаболитов.
Убыль промежуточных продуктов цикла восполняется в реакциях, катализируемых специфическими ферментами. В нормальных условиях реакции, отвлекающие промежуточные продукты из цикла и восполняющие их убыль, находятся в состоянии динамического равновесия, так что концентрация этих продуктов в митохондриях остаётся постоянной.
Реакции, обеспечивающие пополнение фонда промежуточных продуктов ЦТК, называются анаплеротическими (пополняющими). Важнейшая из них — реакция синтеза оксалоацетата из пирувата. Эту реакцию катализирует митохондриальный фермент — пируваткарбоксилаза.
 Пируваткарбоксилаза — регуляторный фермент. Если концентрация ацетил-КоА увеличивается, то он действует как аллостерический активатор пируваткарбоксилазы, ускоряя образование оксалоацетата. Таким образом, избыток ацетил-КоА способствует активации цитратного цикла.
Последствия.
Пируваткарбоксилаза катализирует превращение пирувата в оксалоацетат для глюконеогенеза. А если не будет аксалоацетата, то не будет глюконеогенеза. А из-за этого в результате может быть гипогликемия натощак.
Пируваткарбоксилаза — регуляторный фермент. Если концентрация ацетил-КоА увеличивается, то он действует как аллостерический активатор пируваткарбоксилазы, ускоряя образование оксалоацетата. Таким образом, избыток ацетил-КоА способствует активации цитратного цикла.
Последствия.
Пируваткарбоксилаза катализирует превращение пирувата в оксалоацетат для глюконеогенеза. А если не будет аксалоацетата, то не будет глюконеогенеза. А из-за этого в результате может быть гипогликемия натощак.

 б)
б)
 Снижается, потому что доноры водорода образуются только в одной реакции ЦТК: окисления малата в оксалоацетат. Все остальные донорные реакции не идут, потому что в среде нет пирувата.
в) Нужно связать оксалоацетат, добавив пируват или ацетил-КоА
Снижается, потому что доноры водорода образуются только в одной реакции ЦТК: окисления малата в оксалоацетат. Все остальные донорные реакции не идут, потому что в среде нет пирувата.
в) Нужно связать оксалоацетат, добавив пируват или ацетил-КоА
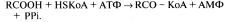
 Реакция, которая написана перед окислением и та, в которой ферментом является β-кетоацил-КоА-тиолаза.
в) Голодание, гиповитаминозы B1, PP, B2; гипоксия.
Реакция, которая написана перед окислением и та, в которой ферментом является β-кетоацил-КоА-тиолаза.
в) Голодание, гиповитаминозы B1, PP, B2; гипоксия.
 б) У нетренированных людей лактоацидоз возникает при физической работе как следствие относительного недостатка кислорода в мышцах и развивается достаточно быстро. Компенсация осуществляется путём гипервентиляции. У тренированных людей много кислорода запасено в миоглобине. Гипоксия мышцы развивается позже или при бОльших нагрузках. Большое количество митохондрий обеспечивает быстрое и высокоэффективное аэробное окисление требуемого количества энергоносителей.
б) У нетренированных людей лактоацидоз возникает при физической работе как следствие относительного недостатка кислорода в мышцах и развивается достаточно быстро. Компенсация осуществляется путём гипервентиляции. У тренированных людей много кислорода запасено в миоглобине. Гипоксия мышцы развивается позже или при бОльших нагрузках. Большое количество митохондрий обеспечивает быстрое и высокоэффективное аэробное окисление требуемого количества энергоносителей.


 Глюкоза-6-фосфат не переходит в глюкозу из-за дефекта фермента глюкозо-6-фосфатазы
б), в)Из-за увеличения содержания в клетках глюкозо-6-фосфата возрастает его использование в пентофосфатном пути с образованием рибозо-5-фосфата, который является субстратом для синтеза пуриновых нуклеотидов. Их образуется и разрушается больше, в связи с этим увеличивается концентрация мочевой кислоты, как продукта распада нуклеотидов.
Увеличение содержания в клетках глюкозо-6-фосфата приводит к его избыточному превращению в пируват и лактат. Накопление лактата приводит к лактоацидозу. Ацидоз в свою очередь приводит к снижению pH мочи, что также затрудняет выведение мочевой кислоты и уратов.
Глюкоза-6-фосфат не переходит в глюкозу из-за дефекта фермента глюкозо-6-фосфатазы
б), в)Из-за увеличения содержания в клетках глюкозо-6-фосфата возрастает его использование в пентофосфатном пути с образованием рибозо-5-фосфата, который является субстратом для синтеза пуриновых нуклеотидов. Их образуется и разрушается больше, в связи с этим увеличивается концентрация мочевой кислоты, как продукта распада нуклеотидов.
Увеличение содержания в клетках глюкозо-6-фосфата приводит к его избыточному превращению в пируват и лактат. Накопление лактата приводит к лактоацидозу. Ацидоз в свою очередь приводит к снижению pH мочи, что также затрудняет выведение мочевой кислоты и уратов.
 А если недостаточность тиамина:
А если недостаточность тиамина:


 В печени присутствует фермент Глюкозо-6-фосфатаза, а в мышцах его нет, поэтому глюкоза из гликогена в мышцах может использоваться только там, а в печени также может идти в кровь и поддерживать уровень себя в крови.
В печени присутствует фермент Глюкозо-6-фосфатаза, а в мышцах его нет, поэтому глюкоза из гликогена в мышцах может использоваться только там, а в печени также может идти в кровь и поддерживать уровень себя в крови.

 Аэробный распад глюкозы
Аэробный распад глюкозы

 У спортсмена совершающего пробежку в интенсивно работающих мышцах происходят процессы гликолиза, при этом в результате анаэробного гликолиза (в первые минуты - при нехватке кислорода (затем идет аэробный), и при длительной работе) образуется лактат. Он вступает в "глюкозо-лактатный цикл", или цикл "Кори".
У спортсмена совершающего пробежку в интенсивно работающих мышцах происходят процессы гликолиза, при этом в результате анаэробного гликолиза (в первые минуты - при нехватке кислорода (затем идет аэробный), и при длительной работе) образуется лактат. Он вступает в "глюкозо-лактатный цикл", или цикл "Кори".
 В печени отношение NADH\NAD+ ниже, чем в сокращающейся мышце, поэтому лактатдегидрогеназная реакция протекает в сторону образования пирувата из лактата. Далее пируват включается в глюкогенез, а образовавшаяся глюкоза поступает в кровь и поглощается скелетными мышцами.
Значение.
1) утилизация лактата - предотвращение лактоацидоза;
2) синтез глюкозы
При длительной мышечной работе могут образовываться аминокислоты, в результате распада мышечных белков, которые при катаболизме превращаются в пируват или метаболиты цитратного цикла (гликогенный аминокислоты) и способны включаться в глюконеогенез.
В печени отношение NADH\NAD+ ниже, чем в сокращающейся мышце, поэтому лактатдегидрогеназная реакция протекает в сторону образования пирувата из лактата. Далее пируват включается в глюкогенез, а образовавшаяся глюкоза поступает в кровь и поглощается скелетными мышцами.
Значение.
1) утилизация лактата - предотвращение лактоацидоза;
2) синтез глюкозы
При длительной мышечной работе могут образовываться аминокислоты, в результате распада мышечных белков, которые при катаболизме превращаются в пируват или метаболиты цитратного цикла (гликогенный аминокислоты) и способны включаться в глюконеогенез.
 Значение: транспорт аминного азота из мышц в печень и предотвращение лактоацидоза.
Значение: транспорт аминного азота из мышц в печень и предотвращение лактоацидоза.
 Пируват потом переходит в ЦТК.
Пируват потом переходит в ЦТК.

 Влияние инсулина:
Влияние инсулина:
 Так же на обмен гликогена может влиять адреналин в экстремальной ситуации.
Так же на обмен гликогена может влиять адреналин в экстремальной ситуации.
 Какая система передачи сигнала в клетку будет использована, зависит от рецепторов, с которыми взаимодействует адреналин.
Какая система передачи сигнала в клетку будет использована, зависит от рецепторов, с которыми взаимодействует адреналин.
 Бифункциональный фермент (БИФ) катализирует прямую и обратную реакции образования фруктозо-2,6-бисфосфата путём фосфорилирования фруктозо-6-фосфата. Однако превращение фруктозо-2,6-бисфосфата в фрук-тозо-6-фосфат не является обратимым процессом. Образование фруктозо-2,6-бисфосфата требует затрат АТФ, а при образовании фруктозо-6-фосфата из фруктозо-2,6-бисфосфата гидролитически отщепляется неорганический фосфат.
В реакции фосфорилирования фруктозо-6-фосфата фермент проявляет киназную активность, а при дефосфорилировании образованного фруктозо-2,6-бисфосфата — фосфатазную. Это обстоятельство и определило название фермента «бифункциональный».
Киназная активность БИФ проявляется, когда фермент находится в дефосфорилированной форме (БИФ-ОН). Дефосфорилированная форма БИФ характерна для абсорбтивного периода, когда инсулин/глюкагоновый индекс высокий. В этот период количество фруктозо-2,6-бисфос-фата увеличивается.
При низком инсулин-глюкагоновом индексе, характерном для периода длительного голодания, происходит фосфорилирование БИФ, и он функционирует как фосфатаза. Результат — снижение количества фруктозо-2,6-бисфосфата.
Киназную и фосфатазную реакции катализируют разные активные центры БИФ, но в каждом из двух состояний фермента (фосфорили-рованном и дефосфорилированном) один из активных центров ингибирован. Регуляторное влияние фруктозо-2,6-бисфосфата заключается в том, что он аллостерически активирует фосфофруктокиназу (фермент гликолиза). При этом фруктозо-2,6-бисфосфат снижает ингибирующее действие АТФ на этот фермент в абсорбтивном периоде и повышает его сродство к фруктозо-6-фосфату. В то же время фруктозо-2,6-бисфос-фат ингибирует фруктозо-1,6-бисфосфатазу (фермент глюконеогенеза). Итак, в абсорбтивном периоде уровень фруктозо-2,6-бисфосфата повышается, что приводит к активации фосфофруктокиназы и ускорению гликолиза. Результатом уменьшения количества фруктозо-2,6-бисфосфата в постабсорбтивном периоде будет снижение активности фосфофруктокиназы, замедление гликолиза и переключение гликолиза на глюконеогенез.
Бифункциональный фермент (БИФ) катализирует прямую и обратную реакции образования фруктозо-2,6-бисфосфата путём фосфорилирования фруктозо-6-фосфата. Однако превращение фруктозо-2,6-бисфосфата в фрук-тозо-6-фосфат не является обратимым процессом. Образование фруктозо-2,6-бисфосфата требует затрат АТФ, а при образовании фруктозо-6-фосфата из фруктозо-2,6-бисфосфата гидролитически отщепляется неорганический фосфат.
В реакции фосфорилирования фруктозо-6-фосфата фермент проявляет киназную активность, а при дефосфорилировании образованного фруктозо-2,6-бисфосфата — фосфатазную. Это обстоятельство и определило название фермента «бифункциональный».
Киназная активность БИФ проявляется, когда фермент находится в дефосфорилированной форме (БИФ-ОН). Дефосфорилированная форма БИФ характерна для абсорбтивного периода, когда инсулин/глюкагоновый индекс высокий. В этот период количество фруктозо-2,6-бисфос-фата увеличивается.
При низком инсулин-глюкагоновом индексе, характерном для периода длительного голодания, происходит фосфорилирование БИФ, и он функционирует как фосфатаза. Результат — снижение количества фруктозо-2,6-бисфосфата.
Киназную и фосфатазную реакции катализируют разные активные центры БИФ, но в каждом из двух состояний фермента (фосфорили-рованном и дефосфорилированном) один из активных центров ингибирован. Регуляторное влияние фруктозо-2,6-бисфосфата заключается в том, что он аллостерически активирует фосфофруктокиназу (фермент гликолиза). При этом фруктозо-2,6-бисфосфат снижает ингибирующее действие АТФ на этот фермент в абсорбтивном периоде и повышает его сродство к фруктозо-6-фосфату. В то же время фруктозо-2,6-бисфос-фат ингибирует фруктозо-1,6-бисфосфатазу (фермент глюконеогенеза). Итак, в абсорбтивном периоде уровень фруктозо-2,6-бисфосфата повышается, что приводит к активации фосфофруктокиназы и ускорению гликолиза. Результатом уменьшения количества фруктозо-2,6-бисфосфата в постабсорбтивном периоде будет снижение активности фосфофруктокиназы, замедление гликолиза и переключение гликолиза на глюконеогенез.
