
КАТЕГОРИИ:
АстрономияБиологияГеографияДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРиторикаСоциологияСпортСтроительствоТехнологияФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Потенциометрия
Потенциометрия основана на измерении разности электрических потенциалов, возникающих между разнородными электродами, опущенными в раствор с определяемым веществом. Электрический потенциал возникает на электродах при прохождении на них окислительно-восстановительной (электрохимической) реакции. Окислительно-восстановительные реакции протекают между окислителем и восстановителем с образованием окислительно-восстановительных пар, потенциал φ которых определяется по уравнению Нернста активностями компонентов пар а(Ox) и а(Red):
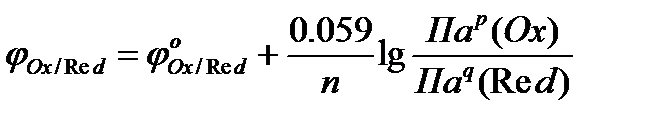
где Пар(Ох) – произведение концентраций ионов из той части уравнения полуреакции, где содержится окисленная форма вещества;
Например, для полуреакции восстановления перманганат-иона в кислой среде
MnO4- + 8H+ + 5e = Mn2+ + 4H2O
уравнение Нернста имеет вид
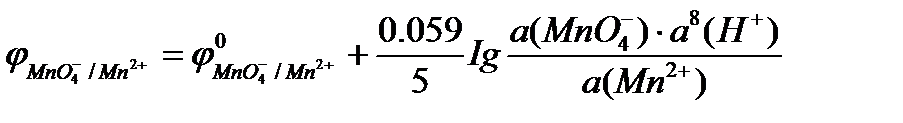
Потенциометрические измерения проводят, опуская в исследуемый раствор два электрода – индикаторный, реагирующий на концентрацию определяемых ионов, и электрод сравнения, относительно которого измеряется потенциал индикаторного. Применяют несколько видов индикаторных электродов и электродов сравнения.
- Электроды первого рода обратимы относительно катионов Mn+ металла M, из которого состоит электрод. При опускании такого электрода в раствор, содержащий катионы металла, образуется электродная пара Mn+/M . Например, пластинка цинка, опущенная в раствор сульфата цинка – это электрод 1-го рода.
- Электроды второго рода чувствительны к анионам и представляют собой металл М, покрытый слоем слаборастворимой его соли МА с анионом A-, к которому чувствителен электрод. При контакте такого электрода с раствором, содержащим указанный анион A-, возникает потенциал φ, величина которого зависит от произведения растворимости ПР(МА) соли МА и концентрации аниона [А-] в растворе.
Электродами второго рода являются, например, хлорсеребряный и каломельный. Насыщенные (слаборастворимой солью МА) хлорсеребряный и каломельный электроды поддерживают постоянный потенциал и применяются в качестве электродов сравнения, по отношению к которым измеряется потенциал индикаторного электрода.
Инертные электроды – пластина или проволока из трудно окисляемых металлов – платины, золота, палладия. Применяются они для измерения φ в растворах, содержащих окислительно - восстановительную пару (например, пару Fe3+/Fe2+, или пару Се4+/Се3+).
Мембранные электроды различного типа имеют мембрану, на которой возникает мембранный потенциал φ. Величина φ зависит от разности концентраций одного и того же иона по разным сторонам мембраны. Простейшим и наиболее часто употребляемым мембранным электродом является стеклянный электрод (со стеклянной мембраной).
Смешивание слаборастворимых солей типа AgBr, AgCl, AgI и других с каучуками и некоторыми пластмассами (полиэтилен, полистирол) привело в свое время к созданию первых ион-селективных электродов на анионы Br-, CI-, I- . Эти электроды избирательно адсорбируют из раствора указанные ионы в соответствии с правилом Панета – Фаянса – Гана. Так как концентрация определяемых ионов вне электрода отличается от таковой внутри электрода, равновесия на противоположных поверхностях мембраны отличаются, что приводит к возникновению мембранного потенциала. Позднее были разработаны и другие ион-селективные электроды.
Правило Панета-Фаянса-Гана. Из содержащихся в растворе двух одинаково заряженных ионов с одинаковой концентрацией на кристаллическом осадке преимущественно адсорбируется тот, который сильнее притягивается зернами осадка. Сила ионного притяжения тем больше, чем ниже растворимость соединения, образуемого этим ионом с противоположным ионом решетки. Сильнее всего притягиваются собственные ионы осадка. В результате поверхность частиц осадка заряжается (положительно или отрицательно), а около поверхности концентрируются противоионы. Например, на поверхности иодида серебра AgI в растворе нитрата серебра Ag NO3 адсорбируются ионы серебра, а в качестве противоионов –нитрат – ионы. Схематически запишем это так: AgI ∙Ag+│ NO3-.
Для проведения потенциометрических определений собирают электрохимическую ячейку из индикаторного электрода и электрода сравнения, которые опускают в анализируемый раствор и подсоединяют к потенциометру. Применяемые в потенциометрии вольтметры имеют большое внутреннее сопротивление (500 - 1000 МОм), поэтому существующие типы потенциометров представляют собой сложные электронные высокоомные вольтметры (значит, через высокоомный вольтметр протекает очень малый ток). Иногда для измерения ЭДС электродной системы в потенциометрах применяют компенсационную схему, позволяющую дополнительно уменьшить ток в цепи ячейки.
Наиболее часто потенциометры применяют для прямых измерений рН, а также показателей концентраций других ионов: pNa, pK, pNH4, pCl. Измерения проводят, используя соответствующие ион-селективные электроды.
Для измерения рН применяют стеклянный электрод и электрод сравнения – хлорсеребряный. Перед проведением анализов необходимо проверить калибровку рН-метров по стандартным буферным растворам, фиксаналы которых прикладываются к прибору.
рН-метры помимо прямых определений рН, pNa, pK, pNH4, pCl и других позволяют проводить потенциометрическое титрование определяемого иона.
Дата добавления: 2015-04-21; просмотров: 221; Мы поможем в написании вашей работы!; Нарушение авторских прав |