
КАТЕГОРИИ:
АстрономияБиологияГеографияДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРиторикаСоциологияСпортСтроительствоТехнологияФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Законы фарадея выход по току. Кинетика электродных процесов.
Электродные процессы протекают на границе фаз и относятся к гетерогенным окислительно-восстановительным процессам. Изучение кинетики и механизма этих процессов – одно из главных направлений электрохимии на современном этапе.
Основными стадиями электродных процессов являются стадии доставки реагента к поверхности электрода, переноса заряда через границу фаз (стадия разряда-ионизации), отвода продуктов реакции в объем фаз. Стадии доставки и отвода имеют одинаковые закономерности и называются стадиями массопереноса. Наряду с указанными, встречаются также и другие стадии. Так, часто электродные процессы осложняются химическими реакциями в объеме раствора или на поверхности электрода, стадиями образования новой фазы, поверхностной диффузии частиц, перехода частиц с поверхности в объем электрода и др.
Наиболее медленная в ряду последовательных стадий определяет суммарную скорость процесса и называется лимитирующей стадией.
В общем случае ток, протекающий через границу электрод/электролит, тратится на сам электродный процесс (фарадеевский ток) и на заряжение двойного электрического слоя ДЭС (ток заряжения). Если свойства ДЭС не изменяются во времени, то ток заряжения равен нулю, и величина протекающего тока, отнесенная к единице поверхности электрода (плотность тока), является мерой скорости самого электродного процесса.
При изучении механизма электродного процесса измеряют его вольтамперную характеристику -ВАХ ( иногда называемую также поляризационной характеристикой), т.е. зависимость плотности тока от потенциала электрода.
Если потенциал электрода соответствует равновесному потенциалу для данного процесса, то суммарный ток через границу фаз равен нулю, поскольку при равновесном потенциале скорости прямого и обратного процессов равны друг другу и равны так называемому току обмена электродного процесса. При переходе к потенциалам, которые меньше равновесного, протекает суммарный катодный ток, т.е. превалирует процесс восстановления. В противоположном случае протекает анодный ток, соответствующий преимущественному процессу окисления реагента. Величина отклонения потенциала от равновесного значения называется поляризацией электрода.
При малых поляризациях ВАХ оказывается линейной. Ход ВАХ при больших поляризациях зависит от природы медленной стадии.
В общем случае перенос реагента в условиях электрохимической реакции осуществляется за счет диффузии, миграции и конвекции. Если стадия переноса является лимитирующей, то отклонение потенциала от равновесного значения происходит из-за уменьшения концентрации реагента по сравнению с его концентрацией в объеме фазы (концентрационная поляризация). При падении концентрации реагента у электрода до нуля достигается предельный диффузионный ток, величина которого зависит от величины объемной концентрации реагента и его коэффициента диффузии.
ВЫХОД ПО ТОКУ Это масса вещества, образовавшегося в результате электролиза при пропускании через раствор тока определенной силы (I - сила тока, измеряется в амперах - А) в течение определенного времени (t, измеряется в секундах - с) . Рассчитывается с помощью 1 закона Фарадея по формуле:
m = (э*I*t)/F, где э - эквивалентная масса вещества, равная отношению его молярной массы к количеству принятых (или отданных) электронов; F = 96 500 Кл - число Фарадея
(т. е. расчет не по другим веществам - участникам реакции (реагентам или продуктам) , а по значениям силы тока и времени электролиза) .
Практический выход по току обычно меньше 100% (если в долях единицы - меньше 1), т. к. на практике, в реальных условиях, обязательно будут потери вещества. В таком случае выход по току равен отношению практической массы продукта электролиза к теоретической, рассчитанной по закону Фарадея; для выражения выхода в процентах результат нужно умножить на 100%. Выход продукта реакции обозначается греческой буквой "эта".
2 ЗАКОН ФАРАДЕЯ при прохождении через раствор или расплав электролитов одинакового количества электричества малой массы образовавшихся на электрожах веществ относится между собой как молярная масса этих эквивалентов. 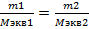
Дата добавления: 2015-01-19; просмотров: 176; Мы поможем в написании вашей работы!; Нарушение авторских прав |