
КАТЕГОРИИ:
АстрономияБиологияГеографияДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРиторикаСоциологияСпортСтроительствоТехнологияФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Измерение электродных потенциалов
Точно измерить электродный потенциал достаточно трудно, так как необходимо, чтобы в процессе измерения не нарушалось равновесие на электродах (отсутствовал ток в цепи). По этой причине невозможно получить точное значение Е с помощью обычного вольтметра: если мы замкнем цепь, используя вместо проводника вольтметр, то в ней начнет протекать довольно большой ток, который нарушит равновесие на электродах. Поэтому для измерения используют специальные вольтметры с высоким входным сопротивлением (более 1000 Ом). При включении в цепь такого прибора протекающий ток окажется достаточно малым для оказания заметного влияния на электродное равновесие.
Стандартный равновесный электродный потенциал - это потенциал электрода при стандартных условиях (активности потенциалопределяющих ионов равны нулю, температура растворов 25оС, давление участвующих в полуреакции газообразных веществ равно 1 атм.), его обозначают символом 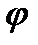 °. Эти потенциалы в водородной шкале определены для многих окислительно-восстановительных систем и приводятся в справочниках. Если электроды (например, металлические электроды 1-го рода) расположить в порядке возрастания потенциала, то мы получим таблицу, называемую рядом стандартных равновесных электродных потенциалов.Этот ряд часто называют также электрохимическим рядом напряжений, однако этот термин устарел, и его постепенно перестают использовать.
°. Эти потенциалы в водородной шкале определены для многих окислительно-восстановительных систем и приводятся в справочниках. Если электроды (например, металлические электроды 1-го рода) расположить в порядке возрастания потенциала, то мы получим таблицу, называемую рядом стандартных равновесных электродных потенциалов.Этот ряд часто называют также электрохимическим рядом напряжений, однако этот термин устарел, и его постепенно перестают использовать.

Li+ K+ Ca2+ Na+ Ba2+ Mg2+ AI3+ Zn2+ Fe2+ Ni2+ Sn2+ Pb2+ H+ Cu2+ Hg22+Ag+ Pt2+ Au+
-3.03 -2.92 -2.87 -2.71 -2.9 -2.37 -1.66 -0.76 -0.44 -0.25 -0.14 -0.13 0.0 0.34 0.79 0.8 1.2 1.68 В
При помощи ряда стандартных равновесных электродных потенциалов можно характеризовать некоторые химические свойства металлов. Например, его применяют для выяснения, в какой последовательности восстанавливаются ионы металлов при электролизе (при их совместном присутствии в растворе).
Чем меньше алгебраическая величина потенциала, тем выше восстановительная способность этого металла и тем ниже окислительная способность его ионов. Как следует из вышеприведенного ряда, металлический литий - самый сильный восстановитель, а золото - самый слабый. И наоборот, ион золота Аu+- самый сильный окислитель, а ион лития Li+ - самый слабый.
Каждый металл М1 в ряду стандартных электродных потенциалов обладает способностью вытеснять все следующие за ним металлы М2 из растворов их солей:
nM1 + mM2n+ = nM1m+ + mM2
Например, Zn + Cu2+(аодн) = Zn2+(водн) + Cu
Однако это не означает, что на практике вытеснение обязательно происходит во всех случаях. Например, алюминий вытесняет медь из раствора хлорида меди (II) СuСl2, но практически не вытесняет ее из раствора сульфата меди (II) CuS04. Это объясняется тем, что хлорид-ион Сl- быстро разрушает защитную оксидную пленку AI2O3 на поверхности алюминии, а сульфат-ион SO42- ее практически не разрушает.
Все металлы, имеющие отрицательные значения стандартных равновесных электродных потенциалов, т.е. стоящие в ряду до водорода, вытесняют водород из разбавленных кислот, анионы которых не проявляют окислительных свойств (например, из НСl или разбавленной H2S04) и растворяются в них. Однако есть и исключения. Например, свинец практически не растворяется в серной кислоте. Это обусловлено образованием на поверхности металла защитной пленки из образующегося слаборастворимого сульфата свинца PbS04, который затрудняет контакт металла с раствором кислоты. Поэтому можно сделать вывод, что пользоваться рядом стандартных электродных потенциалов следует с учетом всех особенностей рассматриваемых процессов.
Дата добавления: 2015-04-21; просмотров: 85; Мы поможем в написании вашей работы!; Нарушение авторских прав |