
КАТЕГОРИИ:
АстрономияБиологияГеографияДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРиторикаСоциологияСпортСтроительствоТехнологияФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Химические свойства
Синильная кислота существует в двух таутомерных формах — нитрильной и изонитрильной:

В обычных условиях в ней содержится 99—99,5% нитрила муравьиной кислоты и 0,5—1% более ядовитого изонитрила.
Синильная кислота является простейшим представителем класса нитрилов, химические свойства которых определяются в основном полярной группой —CN с частичным положительным зарядом на атоме углерода и частичным отрицателиьным арядом на азоте. Некоторые особенности ее свойств обусловлены тем, что атом углерода соединен не с углеводородным радикалом, как у всех нитрилов, а с атомом водорода.
Электронное строение синильной кислоты

обусловливает возможность реакций двух типов — присоединения по тройной связи углерод—азот и с предварительной диссоциацией на протон и циан-ион.
К реакциям АС с раскрытием тройной связи относится, в частности, гидролиз. При взаимодействии с водой синильная кислота очень медленно гидролизуется: сначала до формамида, который затем превращается в аммониевую соль муравьиной кислоты:

Скорость гидролиза возрастает в присутствии сильных кислот и оснований. Так, в 90% серной кислоте при температуре 90 °С синильная кислота количественно гидролизуется до нетоксичной муравьиной кислоты и сульфата аммония. При комнатной температуре и концентрации серной кислоты ниже 70% реакция не происходит.
Водными растворами аммиака, имеющими рН>10, АС гидролизуется до формиата аммония. В менее основных растворах она полимеризуется. Аналогично ведет себя АС с растворами щелочей: концентрированные щелочи превращают ее в токсичные цианистые соли, а разбавленные — в полимеры. В присутствии даже следов оснований синильная кислота быстро окрашивается в красно-коричневый цвет, а через некоторое время начинает выпадать бурый осадок продуктов полимеризации. Иногда процесс полимеризации носит взрывообразный характер. При хранении синильную кислоту стабилизируют минеральными и органическими кислотами, кобальтовыми или никелевыми солями органических кислот.
Возможность АС диссоциировать на протон и цианид-ион обусловливает кислотные свойства соединения, однако АС является очень слабой кислотой — слабее сероводорода и угольной кислоты. Соли ее под действием углекислоты и влаги воздуха из цианидов постепенно превращаются в нетоксичные карбонаты:

Синильная кислота реагирует со всеми окислителями. Сильные окислители превращают ее в циановую кислоту:

Аналогично реагирует бромноватистая кислота. Большинство других окислителей окисляют АС в токсичный дициан:

Последний, являясь динитрилом щавелевой кислоты, в водных растворах может гидролизоваться до диамина этой кислоты:

Диамид образуется, в частности, при взаимодействии синильной кислоты с перекисью водорода.
Кислородом воздуха синильная кислота не окисляется, но, будучи подожжена, хорошо горит:
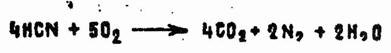
Коллоидная сера, полисернистый аммоний, политионаты превращают АС в роданистоводородную кислоту (реакции 4.1 и 4.2). При обработке АС галоидами или галоидирующими средствами (хлораминами, гипохлоритами, бромаминами) получаются токсичные галоидангидриды циановой кислоты. Например, при пропускании хлора в разбавленный водный раствор синильной кислоты с выходами, близкими к количественному, получают хлорциан:

Реакцию осуществляют при температуре, превышающей температуру кипения хлорциана (12,6 °С).
Одним из важных свойств синильной кислоты, обусловливающих ее крупнотоннажное производство, является способность взаимодействовать с веществами, содержащими карбонильную группу, например с альдегидами и кетонами. Продуктами реакций являются α-оксинитрилы (циангидрины):

Циангидрины перерабатывают в нитрилы и эфиры акриловой и метакриловой кислот, являющиеся мономерами для получения синтетических волокон, каучуков и органических стекол. Взаимодействие АС с формальдегидом (реакция 4.6) может использоваться для дегазации ОВ, а взаимодействие с глюкозой и диоксиацетоном (реакции 4.3 и 4.4) — для профилактики и лечения поражений.
Широко используются в мирной промышленности и реакции нуклеофильнм присоединения синильной кислоты по кратным углерод—углеродным связям:

Синильная кислота легко реагирует в щелочной среде с солями металлов. Получающиеся при этом цианиды тяжелых металлов образуют с цианидами щелочны металлов малорастворимые в воде комплексные соли, многие из которых ярко окрашены. Так, при обработке щелочных растворов АС солями двух- и трехвалентного железа получают ферроцианид железа (берлинскую лазурь) ярко-синего цвета:

Реакцию используют для связывания синильной кислоты и для ее определения. Синильная кислота термически устойчива, но ее пары образуют с воздухом взрывоопасные смеси. Жидкая синильная кислота при детонации взрывается, подобно нитроглицерину.
Дата добавления: 2015-04-15; просмотров: 219; Мы поможем в написании вашей работы!; Нарушение авторских прав |