
КАТЕГОРИИ:
АстрономияБиологияГеографияДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРиторикаСоциологияСпортСтроительствоТехнологияФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Лабораторная работа № 3. Определение ЭДС гальванического элемента. Термодинамика гальванического элемента
Правовое воспитание имеет целью развитие правового сознания человека и правовой культуры общества в целом.
Обычно говорят о правовом воспитании в широком и узком смысле. В первом случае речь идет, скорее, не о правовом воспитании, а о правовой социализации человека, когда он «воспитывается» окружающей обстановкой в целом, всей юридической практикой и поведением людей, должностных лиц - представителей государственного аппарата в правовой сфере. При этом у людей, должностных лиц, государственных органов, осуществляющих правовую деятельность (правомерную или неправомерную), нет прямой цели оказать на других правовоспитательное воздействие. Однако такое воздействие на окружающих все-таки оказывается. Что касается правового воспитания в узком смысле, то оно отличается своей целенаправленностью на повышение правовой культуры человека, группы людей и общества в целом.
! Правовое воспитание тесно связано с правовым обучением: воспитание не может происходить без обучения, а обучение так или иначе оказывает и воспитательный эффект. Различие здесь можно провести, причем весьма условно, по сфере воздействия: воспитание влияет в основном на эмоционально-волевую, ценностную, мировоззренческую сторону сознания, а обучение - на когнитивно-рациональную, с целью информационно-ознакомительного воздействия на человека. Ценностное, эмоционально-волевое воздействие в свою очередь очень сильно ограничено реальной правовой практикой, поскольку невозможно воспитать у человека уважение к тем ценностям, которые отсутствуют в общественном сознании и деятельности людей, но провозглашаются на словах, в пустых декларациях и демагогических заявлениях (как политическими лидерами перед населением, так и простыми воспитателями и учителями перед детьми и юношеством).
Ценности и идеалы «вырастают» спонтанно, формируются самой жизнью, всеми окружающими обстоятельствами, и роль субъективного фактора, целенаправленной деятельности здесь хоть и важна, но не является ведущей, а тем более единственно необходимой и достаточной. И на роль воспитателя годится далеко не каждый. В общественном масштабе таким воспитателем может стать какой-либо выдающийся человек (например, А.Ф. Кони), который «раскроет» людям глаза на истинное положение дел в области защиты прав человека, противостоянии государственному произволу.
По этой причине основной упор в деле повышения правовой культуры общества должен быть сделан на правовое обучение, информирование населения о существующих юридических предписаниях. Очень важно ознакомление населения с образцами и идеалами, правовым опытом и традициями тех стран, где уровень правовой защищенности личности, а следовательно, и уровень правовой культуры, выше, чем в России. Тем более важно обучать этому будущих юристов-профессионалов , чтобы основную цель своей деятельности они видели в защите прав и свобод человека от произвола общества и государства, т. е. в защите слабого от сильного, что является одним из центральных постулатов общемировой, общечеловеческой морали, нравственности и культуры в целом.
Лабораторная работа № 3. Определение ЭДС гальванического элемента. Термодинамика гальванического элемента
3.1. Цель и задачи работ
Ознакомление с компенсационным методом измерения ЭДС гальванических элементов на примере элемента Даниэля-Якоби; расчет и намерение равновесных электродных потенциалов металлов (  ,
,  ); определение основных термодинамических функций состояния и константы равновесия окислительно-восстановительной реакции, лежащей в основе работы, элемента Даниэля-Якоби.
); определение основных термодинамических функций состояния и константы равновесия окислительно-восстановительной реакции, лежащей в основе работы, элемента Даниэля-Якоби.
3.2. Теоретические сведения
Гальванический элемент - прибор, состоящий из ионных и электронных проводников, на границе раздела которых возникает разность электрических потенциалов, или ЭДС. ЭДС элемента равна разности потенциалов двух электродов – катода и анода, т.е.  =
=  (3.1)
(3.1)
Причиной возникновения: ЭДС любого гальванического элемента является протекание в нем химической реакции или изменение активности ионов в растворе вблизи электрода.
При равновесной протекании химической реакций в гальваническом элементе в условиях постоянства температуры и давления получаемая электрическая энергия будет наибольшей, а потому совершаемая системой электрическая работа называется максимальной полезной работой реакции, равной убыли изобарно-изотермического потенциала:
 =
=  (3.2)
(3.2)
Если принять во внимание, что количество электричества,
переносимое в окислительно-восстановительном процессе, составляет h^ кулонов, то электрическая работа, совершаемая элементом, будет
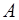 =
= 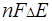 ,(3.3)
,(3.3)
где  - число электронов, участвующих в элементарном акте электрохимической реакции;
- число электронов, участвующих в элементарном акте электрохимической реакции;  - число Фарадея, равное 964487,0 Кл/моль;
- число Фарадея, равное 964487,0 Кл/моль;  - ЭДС гальванического элемента, В.
- ЭДС гальванического элемента, В.
Для обратимого гальванического элемента ЭДС является мерой изменения изобарно-изотермического потенциала реакции, протекающей при работе этого элемента, т.е.
 =
= 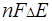 =
=  .(3.4)
.(3.4)
Согласно уравнению Гиббса-Гельмгольца
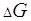 =
= 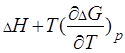 .(3.5)
.(3.5)
Тогда после подстановки для  будем иметь
будем иметь
 .(3.6)
.(3.6)
Температурный коэффициент ЭДС  , входящий в это уравнение, может быть определен экспериментально по зависимости ЭДС гальванического элемента от температуры:
, входящий в это уравнение, может быть определен экспериментально по зависимости ЭДС гальванического элемента от температуры:
 ,(3.7)
,(3.7)
где  и
и  - ЭДС элемента соответственно при температурах
- ЭДС элемента соответственно при температурах  и
и  .
.
Расчет будет тем точнее, чем меньше отличаются между собой  и
и  , так как зависимость
, так как зависимость 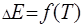 только в узком интервале температур близка к линейной. По зависимости ЭДС oт температуры можно рассчитать изменение энтропии реакции
только в узком интервале температур близка к линейной. По зависимости ЭДС oт температуры можно рассчитать изменение энтропии реакции  , так как
, так как
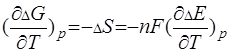 (3.8)
(3.8)
или
 (3.9)
(3.9)
Уравнение (5.6) позволяет рассчитать по экспериментальным данным для  изменение энтальпии реакции:
изменение энтальпии реакции:
 (3.10)
(3.10)
Рассчитанныё с помощью метода ЭДС гальванического элемента значения термодинамических функций позволяют оценить возможность, направление и глубину химического процесса, лежащего в основе работы этого элемента.  отвечает условию самопроизвольности процесса,
отвечает условию самопроизвольности процесса,  определяет глубину процесса,
определяет глубину процесса, 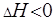 соответствует экзотермической реакции,
соответствует экзотермической реакции,  означает разупорядочение системы при самопроизвольном процессе.
означает разупорядочение системы при самопроизвольном процессе.
Уравнение стандартной изотермы Вант-Гоффа, связывающее энергию Гиббса 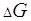 о константой равновесия реакции
о константой равновесия реакции  , позволяет рассчитать эту константу по методу ЭДC.
, позволяет рассчитать эту константу по методу ЭДC.
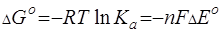 .(3.11)
.(3.11)
Откуда
 .(3.12)
.(3.12)
Через  обозначена ЭДС элемента в стандартных условиях, т.е. при активностях всех ионов, участвующих в реакции, равных единице.
обозначена ЭДС элемента в стандартных условиях, т.е. при активностях всех ионов, участвующих в реакции, равных единице.
В общем случае изотерма Вант-Гоффа имеет вид
 (3.13)
(3.13)
или
 .(3.14)
.(3.14)
С учетом (5.4) уравнение (5.14) принимается в виде
 .(3.15)
.(3.15)
Уравнение (5.15) называется уравнением Нернста. Для реакции, протекающей в элементе Даниэля-Якоби,

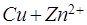 (3.16)
(3.16)
при условии, что активности твердых меди я цинка постоянны, а коэффициент перед десятичным логарифмом с учетом, численного значения каждой константы в уравнении (5.15) составляет 0,059 , получим
 .(3.17)
.(3.17)
Для разбавленных растворов активности в уравнении (5.17) могут быть заменены концентрациями.
ЭДС гальванического элемента Даниэля-Якоби  при стандартных условиях
при стандартных условиях
 (3.18)
(3.18)
вычисляется с помощью таблицы стандартных электронных потенциалов металлов, а электрохимическая реакция (5.16) является суммой отдельных электродных реакций, каждая из которых обуславливает скачок, потенциала на границе металл-раствор. Стандартный электронный потенциал равен ЭДС элемента, составленного из данного электрода и стандартного водородного электрода сравнения, потенциал которого условно принят за нуль.
В элементе  протекает реакция
протекает реакция 
и  (3.19)
(3.19)
5.3. Объекты и средства исследования
Объектом исследования является электрохимическая реакция, протекающая в элементе Даниэля-Якоби. Средством исследования служит компенсационный, метод измерения ЭДС гальванического элемента, позволяющий определять разность потенциалов в условиях обратимой работы элемента и  .
.
На рис.3.1 приведена принципиальная схема измерения ЭДС гальванического элемента.
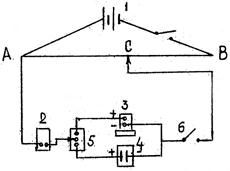
Рис.3.1. Электрическая схема установки для измерения ЭДС гальванических элементов
Компенсационная схема состоит из источника тока аккумулятора 1, напряжение которого подается по реохорду АВ, гальванометра 2 чувствительностью KT'A, элемента Вестона 3, исследуемого элемента 4, переключателя 5, прерывателя 6 и подвижного контакта С.
Метод основан на том, что измеряемая ЭДС уравновешивается (компенсируется) ЭДС аккумулятора, так как они включаются одноименными полюсами навстречу друг другу через реохорд АВ, с которого снимается любая разность потенциалов от нуля до  передвижением контакта С. В момент компенсации гальванометр покажет в боковой цепи отсутствие тока, а ЭДС элемента будет
передвижением контакта С. В момент компенсации гальванометр покажет в боковой цепи отсутствие тока, а ЭДС элемента будет
 .(3.20)
.(3.20)
Для определения  в боковую цепь вместо исследуемого элемента включается нормальный элемент Beстона, ЭДС которого
в боковую цепь вместо исследуемого элемента включается нормальный элемент Beстона, ЭДС которого  точно известна. Гальваническая цепь элемента Вестона имеет вид
точно известна. Гальваническая цепь элемента Вестона имеет вид
 .
.
Скомпенсировав ЭДС нормального элемента  =1,0181 В, получим
=1,0181 В, получим
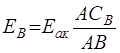 .(3.21)
.(3.21)
Разделив уравнение (5.20) на (5.21), получим ЭДС исследуемого элемента
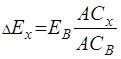 ,(3.22)
,(3.22)
где  - цена деления реохорда.
- цена деления реохорда.
Изменение напряжения в аккумуляторе влияет на цену деления, поэтому в процессе работы необходимо проверять ее для измерения ЭДС вместо реохорда можно использовать высокоомный потенциометр постоянного тока ППТB-I.
5.4. Подготовка к работе
5.4.1. Собрать, исследуемый элемент, для чего зачистить электроды, промыть ячейки, заполнить их соответствующими растворами солей, концентрацию которых указывает преподаватель; заполнить с помощью пипетки электролитические ключи раствором  при открытых кранах, так, чтобы в них не было воздушных пузырьков, после чего краны закрыть; соединить с помощью ключей ячейки между собой через промежуточный сосуд, заполненный раствором
при открытых кранах, так, чтобы в них не было воздушных пузырьков, после чего краны закрыть; соединить с помощью ключей ячейки между собой через промежуточный сосуд, заполненный раствором  , и вставить в последний каломельный электрод сравнения. Следить за тем, чтобы клеммы электродов не соприкасались с растворами.
, и вставить в последний каломельный электрод сравнения. Следить за тем, чтобы клеммы электродов не соприкасались с растворами.
После сборки исследуемый элемент должен иметь вид» изображенный на рис.3.2.
3.4.2. Собрать электрическую цепь для измерения ЭДС при помощи потенциометра ППТВ-I, для чего к клеммам потенциометра, обозначенным буквами "Б", "Г", "Н.Э'', "Х", присоединить, соблюдая полярность, соответственно батарею аккумуляторов на 1,3 или 2,2 В, гальванометр, нормальный элемент и исследуемый элемент.


Рис.3.2. Схема исследуемого гальванического элемента
3.4.3. Установить переключатели нормального элемента рабочий ток потенциометра при  =1,0184 В. Для этого поставить переключатель в положение "Н.Э" и поворотом, ручек (малые курбели) трехдекадного магазина сопротивления добиться компенсации нормального элемента, после чего поставить переключатель в положение "X". В таком состоянии схема готова для проведения измерений.
=1,0184 В. Для этого поставить переключатель в положение "Н.Э" и поворотом, ручек (малые курбели) трехдекадного магазина сопротивления добиться компенсации нормального элемента, после чего поставить переключатель в положение "X". В таком состоянии схема готова для проведения измерений.
3.5. Программа работы
3.5.1. Измерение ЭДС элемента Даниэля-Якоби при заданных концентрациях рабочих электролитов.
В этом случае к клеммам потенциометра "X" должны быть подключены контакты рабочих электродов (медного "+" и цинкового "-").
Поворотом рычагов декадных реостатов (большие курбели) добиться компенсации ЭДС исследуемого элемента и прочитать в окошках декадника общую величину напряжения, которая соответствует  вольтам.
вольтам.
3.5.2. Измерение электронных потенциалов металлов.
В этом случае к клеммам потенциометра "X" должны быть подключены поочередно, контакты каждого из рабочих электронов и электрода сравнения (насыщенный каломельный электрод). Поворотом рычагов декадных реостатов добиваются компенсации ЭДС вспомогательного элемента. Полученное значение ЭДС соответствует потенциалу рабочего электрода, измеренному по каломельному электроду сравнения, так как потенциал насыщенного каломельного электрода принят за нуль. Знак полученной величины электродного потенциала совпадает со знаком клеммы, к котором подключается рабочий электрод. Измеренное значение электродного потенциала соответствующего металла (меди и цинка) переводится в водородную шкалу, для чего к его относительной величине прибавляется величина потенциала насыщенного каломельного электрода, измеренная по нормальному водородному электроду
(  ).
).
3.5.3. Обработка экспериментальных данных.
На основании измеренной величины ЭДС элемента Даниэля-Якоби рассчитать максимальную полезною работу элемента, основные термодинамические функции состояния химической системы, лежащей в основе работы элемента: 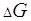 ,
,  ,
, 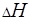 , а также константу равновесия К окислительно-восстановительного процесса.
, а также константу равновесия К окислительно-восстановительного процесса.
Принять температурный коэффициент ЭДС элемента Даниэля-Якоби
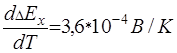 .
.
Используя таблицу стандартных электродных потенциалов, рассчитать по уравнению Нернста величины потенциалов медного и цинкового электродов при заданных значениях •концентрации растворов их солей. Сравнить полученные значения с найденными экспериментально после перевода их в водородную шкалу потенциалов. Рассчитать процент ошибки (  %) при измерении каждого из потенциалов путем сравнения опытных и теоретических величин:
%) при измерении каждого из потенциалов путем сравнения опытных и теоретических величин:


Вычислить теоретическое значение ЭДС элемента Даниэля-Якоби по Нернсту, сравнив его с опытным. Рассчитать процент ошибки в этом случае.
Полученные данные записать в табл. 5.1.
Таблица 3.1
Дата добавления: 2015-01-05; просмотров: 948; Мы поможем в написании вашей работы!; Нарушение авторских прав |