
КАТЕГОРИИ:
АстрономияБиологияГеографияДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРиторикаСоциологияСпортСтроительствоТехнологияФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Направленность ковалентной связи
Направленность ковалентной связи является тем главным свойством, от которого зависит структура молекул и немолекулярных химических соединений. Пространственная направленность ковалентной связи определяет химическое и кристаллохимическое строение вещества. Поэтому нередко МВС называют методом направленной валентности.
Согласно МВС, ковалентная связь направлена в сторону максимального перекрывания электронных облаков взаимодействующих атомов. Нередко электроны, участвующие в образовании химической связи, находятся в различных состояниях, например один валентный электрон на s-орбитали, другой — в р-состоянии и т.д. Так, возбужденный атом бериллия имеет один неспаренный электрон на 2s -орбитали, а другой − на 2р. Тогда в соединениях бериллия с одновалентными элементами, например в ВеС12, две связи не должны быть равноценными. Одна связь Be—С1 должна быть s—р-связью, а другая р-р-связью. Последняя характеризуется большей прочностью, так как р-орбитали более вытянуты от ядра по сравнению с s-орбиталями, а потому сильнее перекрываются с орбиталями других атомов. В то же время совокупность всех свойств молекулы ВеС12 (пар хлорида бериллия) свидетельствует, что обе связи Be — C1 одинаково прочны и расположены под углом 180°, т.е. молекула ВеС12 линейна.
Для объяснения подобных фактов в рамках МВС Полинг ввел представление о гибридизации электронных орбиталей. При этом Полинг исходил из того, что значения энергии Е для s- и р-орбиталей либо совпадают между собой, либо различаются не намного. Тогда состояния валентных электронов описываются не чистыми s-, р-, d-функциями, а смешанными или гибридными волновыми функциями, которые представляют собой линейную комбинацию собственных функций, описывающих состояние исходных электронов.Таким образом, число гибридных орбиталей всегда равно суммарному числу исходных орбиталей. Кроме того, при возникновении гибридных орбиталей необходимо соблюдение следующих условий: 1) хорошее перекрывание гибридизируемых электронных орбиталей; 2) небольшая разница в энергиях атомных орбиталей, участвующих в гибридизаций. Например, ls-орбитали не могут гибридизироваться с 2р-орбиталями, так как у них различные значения главного квантового числа, а потому их энергии сильно различаются. Гибридизация всегда сопровождается изменением формы, электронного облака. При этом гибридное электронное облако асимметрично: имеет большую вытянутость по одну сторону от ядра, чем по другую.
Поэтому химические связи, образованные с участием гибридных орбиталей, обладают большей прочностью, чем связи за счет чистых негибридных электронных облаков. Гибридизация одной s-орбитали и одной р-орбитали приводит к возникновению двух гибридных облаков, расположенных под углом 180° (рис. 1.5).

Рис. 1.5. Схема sp -гибридизации, пример линейной молекулы BeCl2
Это так называемая sp-гибридизация, в результате которой гибридные облака располагаются по прямой. Отсюда легко объяснить прямолинейность молекулы ВеС12: s- и р-орбитали атома бериллия подвергаются sp-гибридизации и образуют две гибридные связи с двумя атомами хлора (рис. 1.5). У каждого атома хлора имеется по одному неспаренному р-электрону, которые и являются валентными.
Комбинация одной s- и двух р-орбиталей приводит к возникновению трех асимметричных гибридных орбиталей, расположенных под утлом 120°. Это sp2-гибридизация. Например, возбужденный атом бора подвергается sp2-гибридизации, в результате ВС13 представляет равносторонний треугольник (рис. 1.6).
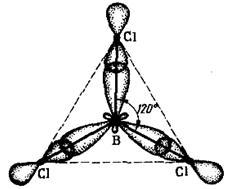
Рис. 1.6. Треугольная молекула ВС13
При sp3-гибридизации четыре гибридных облака располагаются под тетраэдрическим углом 109°28'. Этот угол является оптимальным, обеспечивающим максимальное взаимное удаление и минимальную энергию отталкивания ассиметричных гибридных облаков своими утолщенными частями, что обеспечивает минимум энергии системы. Поэтому молекула метана представляет собой правильный тетраэдр, в центре которого находится атом углерода с четырьмя тетраэдрически направленными гибридными облаками. Четыре атома водорода занимают вершины тетраэдра, химические связи направлены к вершинам тетраэдра (рис. 1.7). Угол между связями равен точно тетраэдрическому.
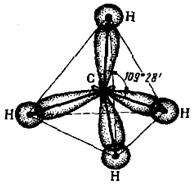
Рис. 1.7. Тетраэдрическая молекула СН4
В атомах с d-электронными орбиталями гибридизация приводит к образованию более сложных конфигураций электронных облаков.
Рассмотрим реальные примеры химического и кристаллохимического строения, типичных неорганических веществ на основе концепции гибридизации электронных орбиталей атомов.
В молекуле аммиака орбитали атома азота подвергаются sp3-гибридизации.
При этом атомы водорода занимают три вершины тетраэдра и образуются три s — sp3-гибридные связи. А четвертая вершина тетраэдра занята гибридным электронным облаком, не участвующим в образовании химической связи. Однако разница в химическом строении метана и аммиака заключается и в том, что угол между связями в аммиаке меньше тетраэдрического и равен 107° (рис. 1.8). Таким образом, геометрическая модель молекулы аммиака представляет собой чуть искаженный тетраэдр. Дело заключается в том, что увеличение «примеси» s-состояния в гибридной орбитали приводит к увеличению угла между связями, тогда как возрастание доли р-состояний уменьшает значение валентного угла.
В структуре молекулы воды угол между связями О—Н равен 104,5°, т.е. близок к тетраэдрическому. Объясняется это тем, что атом кислорода также подвергается неполной sр3-гибридизации. При этом примесь состояния еще меньше, чем для азота в аммиаке. Отсюда геометрическая модель молекулы воды представляет также несколько искаженный тетраэдр, в котором две вершины заняты двумя атомами водорода, а две другие — неэквивалентными электронными облаками, не участвующими в образовании химических связей (рис. 1.9).

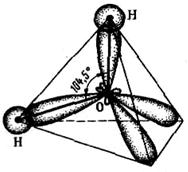
Рис. 1.8. Искаженный тетраэдр Рис. 1.9. Искаженный тетраэдр
молекулы аммиака (NH3) молекулы воды (Н2О)
Итак, материал по гибридизации электронных орбиталей атомов при образовании химических связей подтверждает исключительную плодотворность и важность самой идеи гибридизации в МВС. Прежде всего, гибридизацией определяется химическое и кристаллохимическое строение веществ. А свойства веществ в первую очередь зависят от их химического и кристаллохимического строения. Кроме того, гибридизация делает тождественными неподеленные электронные пары атомов. Наконец, гибридные связи обладают большей прочностью (энергетически более выгодны) по сравнению со связями, образованными чистыми электронными облаками.
Дата добавления: 2015-04-15; просмотров: 358; Мы поможем в написании вашей работы!; Нарушение авторских прав |