
КАТЕГОРИИ:
АстрономияБиологияГеографияДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРиторикаСоциологияСпортСтроительствоТехнологияФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Введение рекомбинантной ДНК в клетки бактерий и отбор трансформантов
Процесс введения рекомбинантной ДНК в бактериальную клетку называется трансформацией. Результатом трансформации является приобретение клеткой-хозяином новых последовательностей ДНК и, следовательно, новых фенотипических признаков, например - устойчивости к определенным антибиотикам. Клетка-хозяин, используемая в таких экспериментах, должна иметь определенный фенотип, в частности r - , т.е. в ней не должно быть ферментов рестрикции; онадолжна быть неспособна к общей рекомбинации (recA-), чтобы экзогенная ДНК не модифицировалась в результате гомологичной рекомбинации. Одна из самых широко используемых для этих целей культур – это лабораторный штамм бактерий E.coli – штамм К12.
Клетки, способные поглощать чужеродную ДНК, называются компетентными. Компетентность E. coli необходимо индуцировать, а некоторые другие бактерии обладают этим свойством изначально. Долю компетентных клеток можно повысить, используя специальную питательную среду или условия культивирования. Для бактерий, устойчивых к химическим индукторам компетентности или не обладающих природной компетентностью, применяются другие системы доставки ДНК.
Самыми часто применяемыми в лабораторной практике приемами трансформации бактериальных клеток являются:
• трансформация E.coli с помощью обработки хлоридом кальция;
• электропорация – увеличение проницаемости клеток под воздействием импульса тока длительностью ~4,5 мс;
Результаты трансформации можно оценивать количественно: определяя либо частоту, либо эффективность трансформации.
Частота трансформации – доля клеток в клеточной популяции, получивших чужеродную ДНК; выражается числом трансформантов к общему числу клеток.
Эффективность трансформации - число трансформантов в расчете на 1 мкг ДНК, взятой для трансформации.
Информация по клонированию рекомбинантных ДНК с помощью плазмидного вектора pBR322, изложенная в данном разделе, суммирована в виде схемы эксперимента и представлена на рисунке 20.
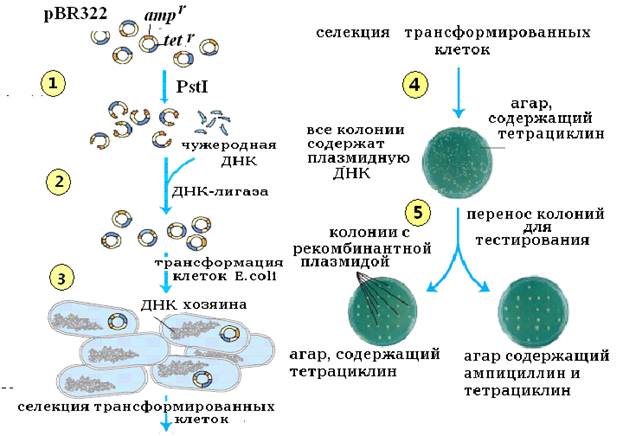
Рис. 20. Клонирование ДНК в плазмидном векторе pBR322
1, 2, 3, 4 и 5 – этапы процедуры клонирования (см. текст).
1. ДНК pBR322 разрезают эндонуклеазой рестрикции PstI в участке, определяющем устойчивость к ампициллину.
2. Фрагменты донорной ДНК, также полученные с помощью PstI и имеющие липкие концы, как и линеаризованный вектор pBR322, с помощью ДНК-лигазы сшивают с векторной ДНК. Следствием образования такой конструкции является деструктурирование гена, обеспечивающего устойчивость к ампициллину. Таким образом, созданная рекомбинантная ДНК при введении в клетки E.coli не сможет обеспечить им выживание на среде с ампициллином.
3. Клетки E.coli трансформируют рекомбинантной ДНК.
4. Суспензию клеток после проведения процедуры трансформации высевают на чашки с агаром и питательной средой, содержащей антибиотик тетрациклин. На этом этапе происходит селекция, т.е. отбор клеток, которые способны расти на среде с тетрациклином. Выросшие на этом агаре клетки содержат рекомбинантную ДНК и ДНК pBR322, в которую не встроилась вставка донорной ДНК, т.е. восстановилась первоначальная структура вектора.
5. Индивидуальные колонии клеток E.coli, выросшие на чашке с тетрациклином пересевают на чашки две чашки, одна из которых содержит агар с ампициллином, а вторая – с тетрациклином. Клетки, содержащие рекомбинантную плазмидную ДНК, растут только на агаре с тетрациклином, поскольку ген, обеспечивающий устойчивость к ампициллину у них деструктурирован за счет встраивания донорной ДНК. В то время как клетки с исходной, т.е. восстановленной векторной ДНК pBR322 растут на обеих чашках, поскольку гены устойчивости к обоим антибиотикам находятся в нативном, т.е. в исходном состоянии.
Из клеток отобранных клонов E.coli экстрагируют плазмидную ДНК и анализируют ее структуру.
Другие плазмидные векторы
Эпоха вектора pBR322, начатая Боливаром и Родригесом в самом начале 80-тых годов ХХ-го столетия, продолжается и по сей день. Однако, при всей своей надежности и классическом соответствии всем необходимым для векторов требованиям, этот вектор имеет всего несколько удобных сайтов для клонирования. Кроме того, отбор трансформированных клеток в экспериментах с рекомбинантными ДНК на его основе занимает много времени. Возникла необходимость разработки альтернативных, более совершенных, систем клонирования. Так была создана группа векторов семейства pUC. В названии векторов этого семейства буквы ”U” и “C” – это первые буквы от слов University of California. Исследователями этого университета была создана серия векторов, имебющих важную черту– наличие в структуре ДНК встроенного синтетического полилинкера, который представляет собой последовательность нуклеотидов, составленную из сайтов узнавания ряда эндонуклеаз рестрикции, уникальных для данного вектора - MCS (Multiple Cloning Sites). Названия индивидуальных векторов из семейства pUC отличаются двузначным числом, а первичная структура разных векторов отличается составом сайтов MCS MCS – Multiple Cloning Sites в полилинкере.
Рассмотрим подробнее особенности векторов, входящих в эту группу, на примере вектора pUC19 (рис. 21).
Плазмида pUC19 имеет длину 2686 п. н. и содержит: ген устойчивости к ампициллину; регулируемый сегмент гена β-галактозидазы (lacZ') лактозного оперона E.coli, ген lacI, кодирующий репрессор, который контролирует экспрессию гена lacZ'; полилинкер — короткую последовательность с множеством уникальных сайтов узнавания для эндонуклеаз (EcoRI, SacI, КрпI, ХmаI, SmaI, BamHI, XbaI, SalI, HinсII, AccI, BspMI, PstI, SphI и HindIII); точку начала репликации плазмиды ColE1.
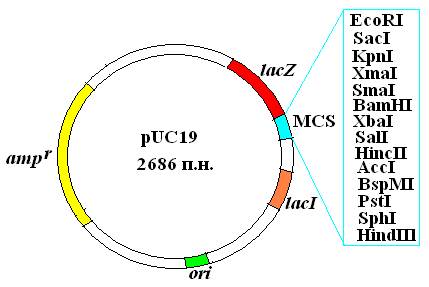
Рис. 21. Плазмидный вектор pUC19
Объяснение к карте дано в тексте.
Присутствие в плазмиде pUC19 гена, обеспечивающего устойчивость к ампициллину, позволяет отбирать клоны E.coli, содержащие данный вектор или рекомбинантные ДНК на его основе на питательных средах с этим антибиотиком. Такие модульные элементы структуры рассматриваемого вектора как lacZ', lacI и MCSдают возможность ускорить и интенсифицировать процедуру селекции клонов с рекомбинантными ДНК.
Если клетки, содержащие немодифицированную плазмиду pUC19, выращивать в присутствии изопропил-β-D-тиогалактопиранозида (ИПТГ), который является индуктором lac-оперона, то продукт гена lacI, так называемый репрессор, не сможет связаться с промоторно-операторной областью гена lacZ', и как следствие будут происходить транскрипция и трансляция плазмидного фрагмента гена lacZ'. Продукт этого фрагмента свяжется с белком, кодируемым хромосомной ДНК (α-комплементация), и в результате образуется активная ß-галактозидаза. Последовательность с множеством сайтов рестрикции (полилинкер) встроена в ген lacZ' так, что она не влияет на продукцию функциональной β-галактозидазы, и если в среде присутствует ее субстрат 5-бром-4-хлор-3-индолил-β-D-галактопиранозид (X-Gal), то он будет гидролизоваться под действием этого фермента с образованием продукта синего цвета, окрашивающего колонии клеток, содержащих немодифицированную, т.е. без вставки чужеродной ДНК, плазмиду pUC19 (рис. 22).

Рис. 22. Последовательность процедур клонирования ДНК в векторе pUC19.
1, 2, 3 и 4 – этапы клонирования (см. текст)
1. Донорную ДНК обрабатывают одной из эндонуклеаз рестрикции, для которой имеется сайт в полилинкере. Векторную ДНК pUC19 обрабатывают тем же ферментом
2. Лигирование линеаризованного вектора и вставки с помощью ДНК-лигазы Т4.
3. После процедуры лигирования инкубационной смесью проводят трансформацию клеток, способных к α-комплементации, которые могут синтезировать ту часть ß-галактозидазы (LacZα), которая соединяется с продуктом гена lacZ' с образованием активного фермента.
4. Обработанные клетки высевают на питательную среду с ампициллином, ИПТГ и субстратом для ß-галактозидазы. Нетрансформированные клетки не могут расти в присутствии ампициллина, а клетки, несущие интактную плазмиду, образуют на среде с ампициллином колонии синего цвета. Клетки-хозяева, несущие гибридную, т.е. рекомбинантную, плазмиду, образуют на той же самой среде белые колонии. Это связано с тем, что обычно при встраивании в полилинкер чужеродной ДНК не может образовываться полноценный продукт гена lacZ', и, следовательно, в процессе α-комплементации не образуется активная ß-галактозидаза, расщепляющая субстрат X-Gal до продукта, который и обеспечивает окрашивание клеток колоний в синий цвет.
Векторы на основе бактериофага λ
Плазмидные векторы позволяют клонировать фрагменты ДНК, размеры которых не превышают 10 т.п.н. Однако для решения задачи клонирования хромосомной ДНК даже небольшого организма, например – бактерии, необходимо создавать полные коллекции фрагментов этой ДНК, поэтому часто приходится работать с более крупными фрагментами. Для этого были разработаны векторы на основе бактериофага λ Ε. coli.
При проникновении фага λ в клетки E.coli. существуют два альтернативных пути развития событий:
1. Литический цикл – фаг начинает активно размножаться и примерно через 20 минут клетка разрушается с высвобождением до 100 новых фаговых частиц.
2. Состояние лизогении – фаговая ДНК включается в хромосому E.coli как профаг и реплицируется в клетке вместе с нормальными бактериальными клетками. Однако при неблагоприятных условиях (нехватка питания) запускается литический цикл (рис. 23):
1. При репликации кольцевой ДНК бактериофага λ образуется линейная молекула, состоящая из повторяющихся сегментов длиной примерно 50 т.п.н. Каждый из этих сегментов представляет собой полноразмерную фаговую ДНК, фланкированную липкими cos-сайтами - одноцепочечными 5'-«хвостами» из 12 нуклеотидов. Их называют липкими (cos) концами, поскольку они взаимно комплементарны и могут спариваться друг с другом подобно липким концам рестрикционных фрагментов.
2. Фаговая головка вмещает один такой сегмент, затем к головке присоединяется уже собранный отросток.

Рис. 23. Литический путь развития бактериофага λ
1 – упаковка в головку фага одного сегмента полноразмерной фаговой ДНК; 2 – сборка полноценной фаговой частицы.
Размер ДНК фага λ составляет примерно 50 т. п. н., причем значительная ее часть (около 20 т. п. н.) несущественна для размножения фага и отвечает за его встраивание в хозяйскую ДНК. В связи с этим возникла идея, что ее можно заменить фрагментом другой ДНК эквивалентного размера. Образующаяся рекомбинантная молекула будет реплицироваться в клетке как ДНК «рекомбинантного" фага, “вставшего" на литический путь развития. Рекомбинантные молекулы упаковывают в головки бактериофага λ in vitro и после добавления отростков получают инфекционные фаговые частицы (рис. 24).
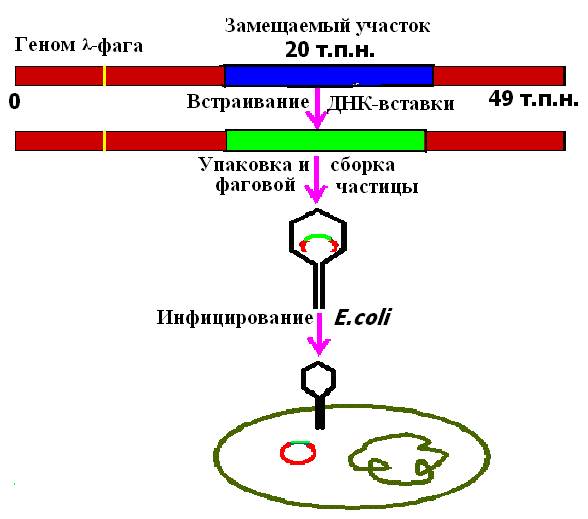
Рис. 24. Использование векторов на основе фага λ для клонирование фрагментов ДГК в клетках Ε. сoli.
Приготовление экстрактов для осуществления упаковки in vitro ДНК фага λ проводят с помощью двух штаммов E.coli, каждый из которых лизогенен в отношении определенного мутантного штамма фага λ (рис. 25). Один из мутантов не способен синтезировать белок А (один из полипептидов фаговой терминазы), другой – белок Е (белок головки фага). Оба этих белка необходимы для упаковки ДНК фага λ. “А”- и “Е”-экстракты смешивают и добавляют конкатемерную (сегменты полноразмерной фаговой ДНК, полимеризованные по cos-сайтам) ДНК фага, которая связывается с терминазой прежде, чем происходит разрезание в cos-сайтах, и упаковывается в фаговые головки.
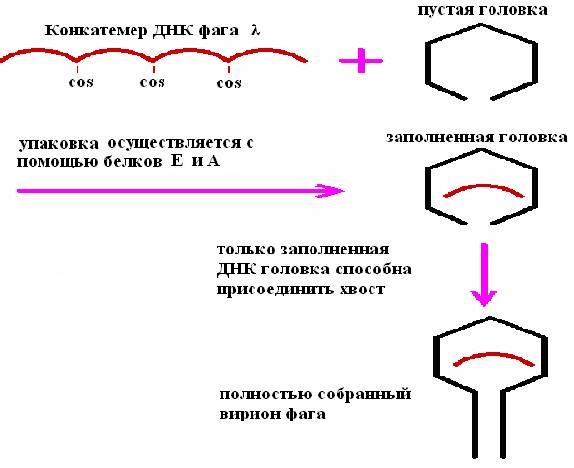
Рис. 25. Упаковка in vitro ДНК фага λ
При упаковке молекулы ДНК длиной менее 38 т.п.н. получается неинфекционная фаговая частица, а фрагменты длиной более 52 т, п. н. не умещаются в головку. Сегменты длиной 50 т. п. н. в линейной молекуле ДНК разделены cos-сайтами, и именно по этим сайтам разрезается молекула, когда очередной сегмент заполняет головку. Разрезание осуществляет фермент, находящийся у входа в головку.
Процесс введения рекомбинантной фаговой ДНК со встроенным фрагментом чужеродной генетической информации в клетки-реципиенты основан на естественном природном явлении – трансдукции фаговой ДНК.
Трансдукция (лат. transduction - перемещение) представляет собой процесс переноса бактериальной ДНК из одной клетки в другую бактериофагом. Таким образом, трансформация бактериальных клеток с помощью рекомбинантных ДНК на основе фаговой ДНК не требует специальной подготовки клеток-реципиентов или какого-либо специального приборного оснащения.
Для поиска клеток, содержащих фаги с рекомбинантными ДНК, используют методы молекулярной гибридизации и иммунологический скрининг, которые рассмотрим в следующем разделе.
Дата добавления: 2015-04-16; просмотров: 705; Мы поможем в написании вашей работы!; Нарушение авторских прав |