
КАТЕГОРИИ:
АстрономияБиологияГеографияДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРиторикаСоциологияСпортСтроительствоТехнологияФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
ГЛАВА 16. бытке субстрата (питательных веществ) и в отсутствие ингибирования роста каким-либо соединением, присутствующим в культуральной среде
бытке субстрата (питательных веществ) и в отсутствие ингибирования роста каким-либо соединением, присутствующим в культуральной среде, удельная скорость роста не зависит от концентрации субстрата. Кривую роста при таких условиях можно описать математически, что позволяет биотехнологам моделировать процесс, а затем провести его масштабирование. Прирост клеточной массы во времени dX/dt равен произведению удельной скорости роста μ на биомассу X:
dX/dt= μΧ.
Аналогично, прирост числа клеток dN/dt равен произведению удельной скорости μ на число клеток Ν:
dN/dt =μΝ.
Удельная скорость μ зависит от концентрации лимитирующего субстрата (источника углерода или азота) S, максимальной удельной скорости роста μmах и субстратспецифичной константы Ks:
μ = μmахS/(KS+S).
И S, и KS имеют размерность концентрации (г/л или М).
Иногда вместо удельной скорости роста используют время удвоения, или время генерации 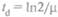 . Это время, зa которое в определенных условиях число клеток или биомасса удваивается. Для одноклеточных микроорганизмов вели-чина μmах обычно находится в диапазоне от 2,1 до 0,086 ч-1, что соответствует времени удвоения примерно от 20 мин до 8 ч.
. Это время, зa которое в определенных условиях число клеток или биомасса удваивается. Для одноклеточных микроорганизмов вели-чина μmах обычно находится в диапазоне от 2,1 до 0,086 ч-1, что соответствует времени удвоения примерно от 20 мин до 8 ч.
Когда субстрат присутствует в избытке (т. е. при 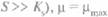 и достигается максимальная скорость роста культуры в экспоненциальной фазе. Как правило, величина Ks настолько мала, что концентрация субстрата редко становится сравнимой с Ks во время экспоненциальной фазы. Например, в случае Escherichia coli Ks для глюкозы равна примерно 1 мг/л, а начальная концентрация глюкозы в среде обычно составляет около 10 000 мг/л. Однако в конце экспоненциальной фазы субстрата остается мало, и S может стать ниже Ks. При S < Ks быстро наступает фаза замедления. Она может быть очень кратковременной или даже практически незаметной, поскольку из-за большого числа клеток в конце экспоненциальной фазы субстрат может быть израсходован очень быстро.
и достигается максимальная скорость роста культуры в экспоненциальной фазе. Как правило, величина Ks настолько мала, что концентрация субстрата редко становится сравнимой с Ks во время экспоненциальной фазы. Например, в случае Escherichia coli Ks для глюкозы равна примерно 1 мг/л, а начальная концентрация глюкозы в среде обычно составляет около 10 000 мг/л. Однако в конце экспоненциальной фазы субстрата остается мало, и S может стать ниже Ks. При S < Ks быстро наступает фаза замедления. Она может быть очень кратковременной или даже практически незаметной, поскольку из-за большого числа клеток в конце экспоненциальной фазы субстрат может быть израсходован очень быстро.
В результате истощения лимитирующего субстрата (например, источника углерода) или накопления продуктов метаболизма, замедляющих рост, увеличение числа клеток постепенно прекращается и культура переходит в стационарную фазу. В это время биомасса остается постоянной, однако метаболизм часто претерпевает кардинальные изменения. Именно в этот период нередко синтезируются соединения (вторичные метаболиты), представляющие коммерческий интерес, например антибиотики. Продолжительность стационарной фазы зависит от конкретного организма и условий роста.
В фазе отмирания энергетические запасы клеток оказываются исчерпанными, и метаболизм прекращается. В большинстве промышленных процессов ферментацию останавливают и клетки собирают еще до наступления фазы отмирания.
Периодическая культура с добавлением субстрата
В этом случае в ферментер периодически добавляют субстрат, а конечный продукт собирают только по завершении процесса. Добавление субстрата приводит к удлинению экспоненциальной и стационарной фаз и к увеличению биомассы и количества метаболитов, синтезируемых во время стационарной фазы (например, антибиотиков). Однако в стационарной фазе микроорганизмы часто синтезируют протеолитические ферменты (протеиназы), разрушающие все производимые ими белки. Поэтому, если целью ферментации является получение белковых продуктов, нужно остановить процесс до его перехода в эту фазу. Прямое измерение концентрации субстрата в ходе ферментации часто бывает затруднено, и чтобы определить, в какой момент нужно добавить следующую порцию субстрата, приходится использовать другие показатели, коррелирующие с его расходованием, например количество синтезированных органических кислот, значение pH или количество образовавшегося СО2. Вообще говоря, ферментеры периодического действия с добавлением субстрата требуют постоянного и более тщатель-
Промышленный синтез белков при участии рекомбинантныхмикроорганизмов 353
ного контроля, чем простые ферментеры периодического действия, и поэтому используются реже. Но они имеют ряд преимуществ, если говорить о разработке систем получения белков с помощью рекомбинантных микроорганизмов, а потому становятся все более популярными.
Периодическое добавление субстрата к растущей культуре рекомбинантных микроорганизмов продлевает экспоненциальную фазу и отсрочивает наступление стационарной фазы, во время которой инициируются клеточные ответы на стрессовые воздействия, происходит синтез протеиназ и другие изменения метаболизма, уменьшающие выход рекомбинантного белка. Для поддержания метаболизма клетки-хозяина количество добавляемого субстрата необходимо постоянно увеличивать. Чтобы обеспечить непрерывный синтез рекомбинантного белка и его стабильность, нужно тщательно контролировать процесс и добавлять субстрат (источник углерода и азота вместе с микроэлементами) сразу, как только в этом возникнет необхолмость. В завпсимости от генотипа микроорганизма и природы рекомбинантного белка при периодической ферментации с добавлением субстрата выход продукта может возрасти на 25—1000 % по сравнению с простой периодической ферментацией.
Периодическую ферментацию с добавлением субстрата можно использовать для культивирования не только микроорганизмов, но и клеток млекопитающих и насекомых. Это очень важно, поскольку: ]) такие культуры все шире применяются для получения белковых продуктов, имеющих медицинское значение; 2) без периодического добавления субстрата животные клетки не очень эффективно синтезируют чужеродные белки.
Непрерывная культура
При непрерывной ферментации стационарные условия, т, е. условия, при которых dX/dt = 0, обеспечиваются тем, что при постоянном объеме биореактора убыль числа клеток (удаление продукта) в точности уравновешивается их увеличением в результате деления. Говоря более формальным языком, для непрерывного процесса в стационарном состоянии скорость разведения D, определяемая как скорость притока
среды F, деленная на постоянный объем среды V в биореакторе,
D= F/V,
равна удельной скорости роста μ: D=(dX/dt)(1/X)= μ.
Чтобы получить непрерывную культуру с постоянными гидродинамическими характеристиками, нужно создать условия, при которых удельная скорость роста была бы ниже максимальной величины µmax. Для этого нужно так отрегулировать насос, который контролирует скорость притока F, чтобы объем культуры в биореакторе V поддерживался постоянным.
Важнейшей задачей промышленной ферментации является получение максимального количества продукта при минимуме затрат. Эту задачу можно решить, если для каждого конкретного процесса разрабатывать свою, наиболее эффективную конструкцию ферментера. Вообще говоря, непрерывная ферментация применяется в промышленных целях не так уж часто, прежде всего потому, что ученые накопили наибольший , опыт в работе с периодическими культурами. При этом стоимость получения данного количества биомассы в ферментере непрерывного действия гораздо ниже, чем в ферментере, работающем в периодическом режиме. Такое удешевление обусловливается следующими факторами.
• Для получения данного количества продукта с помощью непрерывной ферментации нужны меньшие биореакторы, чем с помощью периодической.
• При периодической ферментации для сбора клеток, их разрушения и последующей очистки белкового продукта или метаболита, синтезированного микроорганизмом, необходимо крупногабаритное оборудование. В то же время в ферментере непрерывного действия синтез идет постепенно, так что и оборудование может быть не столь громоздким.
• Ферментер, работающий в непрерывном режиме, не простаивает, как ферментер, периодического действия, который нужно время от времени разгружать и подготавливать к повторному использованию. Простой биоре-
354 ГЛАВА 16
актора в связи с ремонтом, чисткой или стерилизацией — основная причина снижения эффективности процесса. При непрерывной ферментации этот простой гораздо меньше.
• Физиологический статус большинства клеток при непрерывной ферментации одинаков, поэтому синтез происходит более согласованно. При периодической же ферментации небольшие различия во времени сбора клеток, который проводят начиная с середины экспоненциальной фазы и заканчивая ее поздним этапом, могут приводить к значительной рассогласованности.
Непрерывную ферментацию уже использовали для промышленного получения белков одноклеточных микроорганизмов, антибиотиков и органических растворителей.
Впрочем, этот способ имеет и свои недостатки.
• Время ферментации в непрерывном режиме иногда составляет 500—1000 ч, при этом некоторые клетки могут потерять рекомбинантные плазмиды. Клетки, не несущие плазмид, обычно расходуют меньше энергии и делятся быстрее, чем те, которые содержат плазмиду, поэтому со временем выход продукта может снижаться из-за уменьшения числа клеток, способных его синтезировать. Эту проблему можно было бы решить, интегрировав клонированный ген в геном организма хозяина.
• Очень трудно поддерживать стерильные условия в промышленных установках в течение долгого времени. Кроме того, для непрерывных процессов необходимо стерильное резервное оборудование, что значительно увеличивает основные затраты.
• К качеству компонентов культуральной среды, используемой при крупномасштабной ферментации, не предъявляются столь высокие требования, как к компонентам среды при ферментации в лабораторных условиях; они могут изменяться от одного процесса к другому, что может приводить к изменению физиологии клеток и снижению производительности.
Репутация периодической ферментации как весьма надежной системы сдерживает переход к любому другому типу ферментации, даже при том что непрерывный режим работы более эффективен. И все-таки недавно было создано сразу несколько установок, лабораторных (до 10 л) и пилотных (до 1000 л), для непрерывной и периодической ферментации с добавлением субстрата — с целью получения белков с помощью рекомбинантных микроорганизмов. Это говорит о том, что более широкое применение непрерывных ферментеров и периодических ферментеров с добавлением субстрата в промышленности -это только вопрос времени.
Повышение эффективности ферментации
Независимо от типа биореактора в ходе ферментации необходимо строго контролировать такие параметры, как концентрация растворенного кислорода, pH, температура и интенсивность перемешивания. Слишком сильное изменение любого из них может существенно снизить скорость роста клеток и стабильность белкового продукта.
Для оптимального роста Е. coli и многих других микроорганизмов, используемых в качестве инструмента экспрессии рекомбинантных белков, обычно нужна хорошо аэрируемая культуральная среда. Максимальная скорость утилизации кислорода при ферментации Qmax зависит от массы клеток X, максимальной удельной скорости роста mах и скорости роста, зависящей от количества потребленного кислорода  . Эта зависимость выражается следующей формулой:
. Эта зависимость выражается следующей формулой:
Qmax = Xµmax/YO2.
Поскольку кислород плохо растворим в воде (0,0084 г/л при 25 °С), он должен подаваться в среду непрерывно. Обычно для аэрации через ферментер продували стерилизованный воздух. Однако при этом в среде образуются пузырьки, и если они слишком велики, то скорость переноса кислорода к клеткам недостаточна для поддержания их роста. Таким образом, в ходе ферментации необходимо с помощью специального датчика контролировать содержание растворенного кислорода в среде, следить за его равно-
Промышленный синтез белков при участии рекомбинантных микроорганизмов 355

|
| Экспрессия гена гемоглобина стимулирует синтез белка в Е. соli в условиях недостатка кислорода |
| С. Khosla, J.E. Curtis, J. DeModena, U.Rinas, J.E. Bailey Bio/Technology 8:849-853. 1990 |
| Поскольку кислород плохо растворим в воде, рост аэробных бактерий часто лимитируется количеством растворенного в культуральной среде кислорода. Эта проблема особенно актуальна при большой плотности культуры или при крупномасштабной ферментации. Чтобы решить ее, биотехнологи попытались увеличить количество кислорода, поступающего в жидкую кулыуральную среду. Предложенные подходы состояли в следующем: 1) подача в кулыуральную среду чистого кислорода вместо воздуха; 2) подача воздуха (или кислорода) под давлением; 3) добавление к культуральной среде хими- | ческих соединений, таких как перфторуглероды, повышающие растворимость кислорода; 4) модификация конструкции ферментера таким образом, чтобы обеспечивались оптимальная аэрация и перемешивание культуральной среды. Все эти подходы решают «кислородную проблему" лишь частично. Для каждого из них существует свой порог, по достижении которого выход продукта уже нельзя повысить дальнейшим добавлением кислорода. В качестве альтернативы Бейли и др. предложили модифицировать микроорганизм, использующийся для культивирования, | таким образом, чтобы он мог более эффективно использовать тот кислород, который присутствует в культуральной среде. Они перенесли ген, кодирующий гемоглоби-ноподобное соединение, из грамотрицательной бактерии Vitreoscilla sp. в несколько рекомбинантных бактерий. Бактериальный гемоглобин связывал кислород среды и поддерживал высокую концентрацию его в клетках, что стимулировало рост и экспрессию чужеродного белка. Этот подход проиллюстрировал возможность весьма неожиданного биологического решения трудной технической задачи. |
мерным распределением по всему объему и тщательным перемешиванием культуры, обеспечивающим эффективное диспергирование пузырьков.
Большинство микроорганизмов растут лучше всего при pH от 5,5 до 8,5. Следует иметь в виду, однако, что клеточные метаболиты, поступая в культуральную среду, могут изменять ее pH. Таким образом, необходимо тщательно контролировать pH в ходе ферментации и при необходимости добавлять в ферментер кислоту или щелочь. При этом последние должны быть хорошо перемешаны со средой и равномерно распределены по всему объему.
Еще один параметр, от которого зависит успех ферментации, — температура. Если она ниже оптимальной, то рост микроорганизмов замедляется и интенсивность метаболизма снижается. Если же, напротив, температура слишком высока, то может произойти преждевременная индукция синтеза белка, если он находится под контролем температурочувствительного репрессора, или индукция белков теплового шока, что активизирует клеточные протеиназы и снизит выход белкового продукта.
Тщательное перемешивание культуры необходимо, во-первых, для равномерной доставки питательных веществ к клеткам и, во-вторых, для предотвращения накопления токсичных побочных продуктов метаболизма в каком-нибудь небольшом отсеке биореактора. Эффективное перемешивание относительно легко обеспечить при культивировании в небольших объемах, при крупномасштабном же культивировании поддержание гомогенности культуральной среды становится одной из главных проблем.
Перемешивание культуральной среды влияет и на другие параметры: скорость переноса кислорода из пузырьков газа в жидкую среду, а затем из среды в клетки; эффективность теплопередачи; точность измерения концентрации метаболитов в культуральной жидкости; эффективность диспергирования добавляемых реагентов (кислот, оснований, питательных веществ и т. д.). Исходя из всего этого, можно было бы предположить, что чем интенсивнее культура перемешивается, тем лучше она растет. Однако при чрезмерном перемешивании среды в ней могут возникнуть гидромеханические эффекты, губительные для бактериальных клеток и клеток
Дата добавления: 2015-04-16; просмотров: 238; Мы поможем в написании вашей работы!; Нарушение авторских прав |