
КАТЕГОРИИ:
АстрономияБиологияГеографияДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРиторикаСоциологияСпортСтроительствоТехнологияФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Противоречия существующей теории электролиза воды
Полезность любой теории определяется её возможностями правильно интерпретировать результаты уже существующих экспериментов и прогнозировать возможность получения новых теоретических и экспериментальных данных. Посмотрим, отвечает ли этим требованиям, существующая теория электролиза воды [5], [6], [8], [9], [10], [11], [12], [14], [15]. [19], [20], [23], [24], [29], [31]? Для этого, проанализируем классический способ получения водорода при электролизе воды. Он описан в многочисленных учебниках. Химические реакции, протекающие при этом процессе, используются для расчетов его параметров. Они признаются предельно ясными и не вызывают возражений как среди химиков, так и среди физиков. Посмотрим, действительно ли здесь все так ясно?
Вот как описываются катодные и анодные реакции в учебнике [2]. "На катоде протекает следующая реакция:
 (55)
(55)
Два электрона, поступающие с катода, реагируют с двумя молекулами воды, образуя молекулу водорода  и два иона гидроксила
и два иона гидроксила  . Молекулярный водород образует пузырьки газообразного водорода (после того, как раствор вблизи катода насытится водородом), а ионы гидроксила остаются в растворе.
. Молекулярный водород образует пузырьки газообразного водорода (после того, как раствор вблизи катода насытится водородом), а ионы гидроксила остаются в растворе.
На аноде протекает реакция
 (56)
(56)
Четыре электрона переходят на анод с двух молекул воды, которая разлагается с образованием молекулы кислорода и четырех ионов водорода.
Суммарную реакцию можно получить, умножая уравнение (56) на 2 и суммируя с уравнением (56). Она выглядит следующим образом:
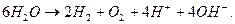 (57)
(57)
... в кислых растворах, с высокой концентрацией ионов водорода, на катоде может просто протекать реакция
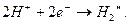 (58)
(58)
Закроем кавычки и зададим такой вопрос: что следует понимать под символом 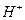 при таком изложении сути процесса электролиза воды? Естественно,
при таком изложении сути процесса электролиза воды? Естественно, 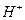 означает положительный ион атома водорода, то есть протон. Однако химики умудрились обозначить этим же символом и положительно заряженный ион гидроксония
означает положительный ион атома водорода, то есть протон. Однако химики умудрились обозначить этим же символом и положительно заряженный ион гидроксония  . Они давно приняли соглашение: в целях упрощения записи, писать
. Они давно приняли соглашение: в целях упрощения записи, писать 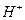 , вместо -
, вместо -  . Вот и приходится гадать: всегда ли под химическим символом
. Вот и приходится гадать: всегда ли под химическим символом 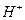 надо понимать совокупность символов
надо понимать совокупность символов  или нет? А если нет, то, как же различать случаи "да" и "нет"? Ведь символ
или нет? А если нет, то, как же различать случаи "да" и "нет"? Ведь символ 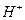 используется в многочисленных других химических реакциях.
используется в многочисленных других химических реакциях.
Если согласиться с процессом электролиза, описанным в приведенном учебнике, то из него следует, что в водном растворе существуют протоны, которые автор обозначает символом 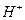 . Имея положительный заряд, они движутся к катоду и, получив от него электрон
. Имея положительный заряд, они движутся к катоду и, получив от него электрон  , образуют вначале атомы водорода
, образуют вначале атомы водорода  , которые, соединяясь, формируют молекулы
, которые, соединяясь, формируют молекулы  , выделяя при этом 436 кДж/моль. По-другому ведь невозможно интерпретировать формулы (56), (57), (58).
, выделяя при этом 436 кДж/моль. По-другому ведь невозможно интерпретировать формулы (56), (57), (58).
Кроме того, из формул (57, 58) следует, что у анода идет процесс синтеза молекул кислорода из его атомов, который должен сопровождаться выделением энергии 495 кДж/моль [2]. Это также надо учитывать при анализе энергетического баланса процесса электролиза воды, но в современной химии не принято проводить такой анализ, так как из него следуют противоречия с экспериментом. Рассмотрим одно из них.
Введем, как это и должно быть, символ 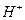 для обозначения только протона. Тогда реакция синтеза атома водорода
для обозначения только протона. Тогда реакция синтеза атома водорода 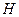 запишется так
запишется так
 (59)
(59)
Реакция синтеза молекулы водорода представится в виде
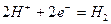 . (60)
. (60)
Гипотеза о присутствии в различных химических растворах свободных протонов атомов водорода плодотворно используется в химии. Однако появление плазменного электролиза воды ставит эту гипотезу под сомнение. Дело в том, что протон - это очень маленькое и очень активное образование, которое может существовать только в составе ядра атома или в составе атома водорода, выполняя роль его ядра. Атом водорода имеет такую структуру, которая обеспечивает ему реализацию функций идеального звена (рис. 4), соединяющего атомы в молекулы.
Таким образом, в электролитическом растворе у протона почти отсутствует фаза существования в свободном состоянии. Отделившись от одного химического элемента, он тут же соединяется с другим.
При плазменном электролизе воды формируются такие условия, когда протон атома водорода, отделившись от молекулы воды, соединяется с электроном, испущенным катодом, и образует атом водорода. Известно, что атомы водорода существуют в свободном состоянии при температуре (2700...10000)  С [13]. Это означает, что при определенной плотности атомов водорода в единице объема должна формироваться плазма с такой температурой. Но при низковольтном электролизе воды плазма атомарного водорода, как известно, не образуется. Это значит, что в этом случае отсутствуют условия существования атомов водорода в свободном состоянии, то есть условия синтеза атомов водорода.
С [13]. Это означает, что при определенной плотности атомов водорода в единице объема должна формироваться плазма с такой температурой. Но при низковольтном электролизе воды плазма атомарного водорода, как известно, не образуется. Это значит, что в этом случае отсутствуют условия существования атомов водорода в свободном состоянии, то есть условия синтеза атомов водорода.
В современной химии известна энергия синтеза молекул водорода (436 кДж/моль), поэтому мы можем рассчитать примерное количество энергии, которое должно выделяться в электролитическом растворе при получении одного кубометра водорода в условиях, когда свободные атомы водорода объединяются в молекулы, как это следует из старой теории электролиза воды (55-59) [2], [7], [13]. В одном кубическом метре водорода содержится 1000/22,4=44,64 моля молекулярного водорода. При его синтезе выделяется энергия
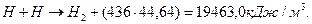 (61)
(61)
Современные лучшие электролизеры расходуют на получение одного кубического метра водорода около 4 кВтч электроэнергии или (3600х4) = 14400 кДж. Учитывая энергию (19463,0 кДж) синтеза одного кубического метра водорода и энергию (14400 кДж), затрачиваемую на его получение, находим показатель тепловой энергетической эффективности низковольтного процесса электролиза воды, следующий из старой теории электролиза воды.
 . (62)
. (62)
Таким образом, простой и строгий расчет показывает, что процесс низковольтного электролиза воды, следующий из его старой теории, должен сопровождаться выделением 35% дополнительной тепловой энергии только в зоне катода.
Обратим внимание на то, что показатель эффективности (62) учитывает только энергию синтеза молекул водорода и не учитывает энергию синтеза атомов водорода и молекул кислорода, а также энергосодержание полученного водорода. Этот показатель (62) подтверждает возможность получения дополнительной энергии, но при условии, чтобы электролиз воды сопровождался процессом синтеза молекул водорода. Отсутствие дополнительной тепловой энергии в работе современных промышленных электролизеров вынуждает нас делать вывод об отсутствии при этом процессе синтеза молекул водорода из его атомов.
Если согласиться с наличием процесса синтеза молекул кислорода, то в зоне анода должна протекать реакция
 , (63)
, (63)
то есть должны формироваться молекулы кислорода и атомы 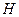 водорода. Но, как известно, при низковольтном электролизе воды в зоне анода выделяется только кислород.
водорода. Но, как известно, при низковольтном электролизе воды в зоне анода выделяется только кислород.
Известно также, что при низковольтном процессе электролиза воды формирование  (44,64 моля) водорода сопровождается выделением 22,32 моля молекулярного кислорода. В результате этого должно выделяться 495х22,32=11048,80 кДж энергии. Складывая эту энергию с энергией синтеза молекул водорода, получим
(44,64 моля) водорода сопровождается выделением 22,32 моля молекулярного кислорода. В результате этого должно выделяться 495х22,32=11048,80 кДж энергии. Складывая эту энергию с энергией синтеза молекул водорода, получим
 (64)
(64)
Тогда общий показатель тепловой энергетической эффективности низковольтного процесса электролиза воды с учётом энергии, выделяющейся в зонах катода и анода, должен быть таким
 (65)
(65)
Но в реальности его нет. Тепловой энергетический показатель современного низковольтного процесса электролиза воды меньше единицы, поэтому возникает вопрос: каким образом формируются молекулы водорода и кислорода при низковольтном процессе электролиза воды, не генерируя ту энергию, которая следует из старой теории этого процесса (61 и 63)? Ответа нет [2].
Дата добавления: 2015-04-16; просмотров: 233; Мы поможем в написании вашей работы!; Нарушение авторских прав |